
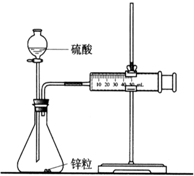
 某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.
某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.分析 (1)金属活动顺序表中排在氢前面的金属可从非强氧化性酸中置换出氢,金属锌可以和硫酸反应生成硫酸锌和氢气,据此书写离子方程式;
(2)浓度越大,反应速率越快,反应产生等量的气体需要的时间越短;
(3)A.研究浓度对反应速率的影响,本实验中所用锌粒的表面积要相同,根据控制变量法来回答;
B.根据测量收集10mL H2所需的时间,要求生成的氢气体积测定必须准确;
C.40mL的H2SO4要迅速加入,防止气体的体积测定误差的出现;
D.氢气的收集可以用排水法收集
E.若用98%的浓H2SO4,金属和浓硫酸的反应产物是二氧化硫,不是氢气;
(4)可通过测定测量等质量的Zn完全溶解所需要的时间、单位时间内H2SO4浓度的变化、收集等体积H2需要的时间长短等角度判断.
解答 解:(1)金属锌在金属活动顺序表中排在氢的前面,可以和硫酸反应生成硫酸锌和氢气,离子方程式为:Zn+2H+=Zn2++H2↑,
故答案为:Zn+2H+=Zn2++H2↑;
(2)1mol•L-1的H2SO4浓度小于4mol•L-1的H2SO4的,浓度越大,反应速率越快,反应产生等量的气体需要的时间越短,
故答案为:大于;小于;
(3)A.研究浓度对反应速率的影响,本实验中所用锌粒的表面积要相同,故A正确;
B.根据测量收集10mL H2所需的时间,要求生成的氢气体积测定必须准确,气密性必须好,故B正确;
C.40mL的H2SO4要迅速加入,防止气体的体积测定误差的出现,故C正确;
D.氢气不溶于水,收集可以用排水法收集,故D正确;
E.若用98%的浓H2SO4,金属和浓硫酸的反应产物是二氧化硫,不是氢气,故E错误.
故答案为:E;
(4)测定Zn和稀H2SO4反应的速率,测定反应物的变化,可通过测量等质量的Zn完全溶解所需要的时间; 单位时间内H2SO4浓度的变化,测定生成物,可通过收集等体积H2需要的时间长短,或其他合理答案,
故答案为:测量等质量的Zn完全溶解所需要的时间; 单位时间内H2SO4浓度的变化(或其他合理答案).
点评 本题考查了测定影响化学反应速率的因素方法,注意知识的迁移和应用是关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L CH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | 将Al2(SO4)3溶液蒸干,灼烧得Al2O3 | |
| C. | 配制FeCl3溶液,应加少量盐酸 | |
| D. | Na2S溶液中:c(OH-)═c(H+)+c(HS-)+2c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,反应的化学方程式为
,反应的化学方程式为 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$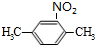 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
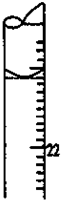 某学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)根据无机含氧酸的酸性规律,将下列四种无机含氧酸按酸性相近两两组成一组,它们是①和④;②和③.(用序号表示)
(1)根据无机含氧酸的酸性规律,将下列四种无机含氧酸按酸性相近两两组成一组,它们是①和④;②和③.(用序号表示)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com