
已知下列热化学方程式:
① Cl 2 (g) + H2 (g)  2HCl (g) Δ H = -184.6 kJ/mol
2HCl (g) Δ H = -184.6 kJ/mol
② CaCO3 (s)  CaO (s) + CO2 (g) Δ H = +178.2 kJ/mol
CaO (s) + CO2 (g) Δ H = +178.2 kJ/mol
③ 2Na (s) + Cl 2 (g)  2NaCl (s) Δ H = -822.0 kJ/mol
2NaCl (s) Δ H = -822.0 kJ/mol
请回答:
(1)上述反应中属于放热反应的是 (填序号,下同),属于吸热反应的是 。
(2)生成1 mol NaCl(s)时,Δ H = ____ kJ/mol。
(3)1000 g CaCO3(s)完全分解时,吸收的热量为____ kJ。
科目:高中化学 来源: 题型:
由乙烯和其他无机原料合成环状酯E和高分子化合物H的示意图如下所示:
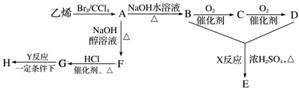
请回答下列问题:
(1)写出以下物质的结构简式:A_____________,F____________,C_________。
(2)写出以下反应的反应类型:X________,Y________。
(3)写出以下反应的化学方程式:
A—→B:_________________________________________________________;
G—→H:______________________________________________________。
(4)若环状酯E与NaOH水溶液共热,则发生反应的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,设计正确且能达到实验目的的是( )
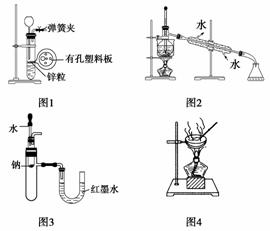
A.用图1所示装置制取少量H2
B.用图2所示装置分离Na2CO3溶液和CH3COOC2H5的混合物
C.用图3所示装置验证Na和水反应的热效应
D.用图4所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
在CuCl2水溶液中存在如下平衡:2++4Cl- 2-+4H2O能使黄绿
(蓝) (绿)
色CuCl2溶液向蓝色转化的操作是
A、蒸发浓缩 B、加水稀释 C、加入AgNO3 D、加入食盐晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
右图曲线a表示放热反应X(g)+Y(g)  Z(g)+M(g)+N(g)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应的过程按b曲线进行,可采取的措施是
Z(g)+M(g)+N(g)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应的过程按b曲线进行,可采取的措施是
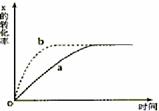 A 加催化剂
A 加催化剂
B加大X的投入量
C 升高温度
D增大体积
查看答案和解析>>
科目:高中化学 来源: 题型:
判断下列热化学方程式书写是否正确(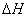 的绝对值均正确),将错误之处划出并写出正确的热化学方程式。(注意:先判断正误,再改正)
的绝对值均正确),将错误之处划出并写出正确的热化学方程式。(注意:先判断正误,再改正)
①.C2H5OH(l)+3O2(g)= 2CO2(g)+3H2O(g) △H= -1367.0 kJ/mol(燃烧热)
_____
②.S(s)+O2(g)= SO2(g) △H= -269.8kJ/mol(反应热)
______________________________________________________________________
③.NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l) △H= +57.3kJ/mol(中和热)___________________________________________________________________________
④.2CO+O2==2CO2 ΔH3=-566.0kJ/mol (反应热)
____________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
对于处于化学平衡状态的反应CO(g)+H2O(g) CO2(g)+H2(g) △H<0,若要提高CO的转化率,下列措施中可行的是
CO2(g)+H2(g) △H<0,若要提高CO的转化率,下列措施中可行的是
| A.升温 | B.增大H2O(g)的浓度 |
| C.增大压强 | D.使用合适的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在固定体积的密闭容器中加入4mol A和2mol B发生如下反应2A(g)+B(g) 3C(g)+D(g)达到平衡时C的浓度为m mol/L,若温度不变时按下列4种配比作为起始物质,达到平衡后C浓度仍为m mol/L的是
3C(g)+D(g)达到平衡时C的浓度为m mol/L,若温度不变时按下列4种配比作为起始物质,达到平衡后C浓度仍为m mol/L的是
A.2molA+1molB B.2molA+1molB+3molC+1mol D
C.3molC+1molD D.4molA+2molB+3molC
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,反应N2(g)+3H2(g) 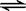 2NH3(g ) 在10L的密闭容器中进行,
2NH3(g ) 在10L的密闭容器中进行,
(1)测得2min内,N2的物质的量由20mol减小到8mol,则2min内H2的反应速率为_____。
(2)当该反应达到化学平衡时,则其平衡常数表达式为 ,如果此时向容器中增加氮气,那么氢气的转化率会 (填增大或降低)。
(3)生成物氨气能与水反应,生成的一水合氨属于 (填强电解质或弱电解质)。
(4)在含有酚酞的0.1 mol / L氨水中加少量的 NH4Cl晶体,则溶液颜色____(填字母)。
A.变蓝色 B.变深 C.变浅 D.不变
(5)工业合成氨的反应为N2(g)+3H2(g)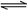 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为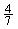 。求(写出计算过程)
。求(写出计算过程)
① 该条件下N2的平衡转化率;
② 该条件下反应2NH3(g)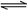 N2(g)+3H2(g)的平衡常数。
N2(g)+3H2(g)的平衡常数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com