
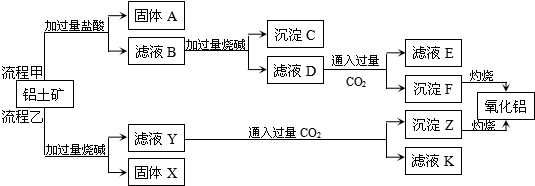
分析 由工艺流程甲可知,铝土矿与盐酸反应得固体A为滤液B,因为铝土矿中有SiO2不反应,则固体A为SiO2,滤液B含有AlCl3、FeCl3、MgCl2等,滤液中加入过量的NaOH,Mg2+、Fe 3+转化为Mg(OH)2、Fe(OH)3沉淀,Al3+转化为AlO2-,然后过滤,滤液D含有NaAlO、NaCl、NaOH,所以向滤液D中通入过量CO2,生成Al(OH)3沉淀与NaHCO3,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;
根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和NaOH溶液反应,可知固体X为Fe2O3、MgO等,滤液Y为Na2SiO3、NaHCO3,滤液中通入过量CO2,沉淀Z为Al(OH)3、硅酸,滤液K中含有NaHCO3,
煅烧氢氧化铝得到氧化铝,据此分析解答.
解答 解:由工艺流程甲可知,铝土矿与盐酸反应得固体A为滤液B,因为铝土矿中有SiO2不反应,则固体A为SiO2,滤液B含有AlCl3、FeCl3、MgCl2等,滤液中加入过量的NaOH,Mg2+、Fe 3+转化为Mg(OH)2、Fe(OH)3沉淀,Al3+转化为AlO2-,然后过滤,滤液D含有NaAlO、NaCl、NaOH,所以向滤液D中通入过量CO2,生成Al(OH)3沉淀与NaHCO3,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;
根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和NaOH溶液反应,可知固体X为Fe2O3、MgO等,滤液Y为Na2SiO3、NaHCO3,滤液中通入过量CO2,沉淀Z为Al(OH)3、硅酸,滤液K中含有NaHCO3,
煅烧氢氧化铝得到氧化铝,
(1)氧化铁和稀硫酸反应生成铁离子、水,离子方程式为Fe2O3+6H+═2Fe3++3H2O,故答案为:Fe2O3+6H+═2Fe3++3H2O;
(2)通过以上分析知,A为SiO2,煅烧氢氧化铝得到氧化铝,反应方程式为2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:SiO2;2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(3)氧化铝是两性氧化物,能溶于强碱溶液生成偏铝酸盐和水,所以和NaOH溶液反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O;
(4)通过以上分析知,X是不和NaOH反应的物质,为Fe2O3、MgO,故答案为:Fe2O3、MgO.
点评 本题考查物质分离和提纯,为高频考点,涉及元素化合物之间的转化、物质的性质等知识点,明确流程图中各个步骤发生的反应及操作方法是解本题关键,侧重考查学生分析与实验能力,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:Na-K合金<Na<氯化钠 | |
| B. | 非金属氢化物的稳定性顺序:H2O>H2S>H2Se,HCl<H2S<PH3 | |
| C. | CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2 | |
| D. | 同一原子中,2p、3p、4p能级的轨道数依次增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)电镀时,镀件与电源的负极连接.
(1)电镀时,镀件与电源的负极连接.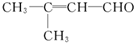 含氧官能团有醛基.
含氧官能团有醛基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | ||
| C. | SO3+H2O═H2SO4 | D. | 2Na+2H2O═2NaOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5?mol•L-1 | B. | 2.5?mol•L-1 | C. | ?d/400 mol•L-1 | D. | ?d/200mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 智能手机上用的锂离子电池属于二次电池 | |
| B. | 碱性锌锰干电池中,锌电极是负极 | |
| C. | 铅蓄电池中,Pb02做负极 | |
| D. | 铜锌原电池(稀硫酸做电解质)工作时,锌电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃、陶瓷、水泥 | B. | 塑料,合成纤维、橡胶 | ||
| C. | 青铜、碳素钢、硬铝 | D. | 玻璃钢、聚乙烯、超导陶瓷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
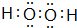 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com