
【题目】对下列说法不正确的是( )
A. 硫化氢气体不能用浓硫酸干燥,是因为硫化氢有还原性
B. 医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于酸
C. 硫燃烧生成二氧化硫,是因为硫有还原性
D. 因为硫有氧化性,则硫与铁反应生成硫化铁
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请回答下列问题:
(1)第三周期元素中,钠原子核外有_______种能量不同的电子;氯原子的最外层电子排布式为______________;由这两种元素组成的化合物的电子式为__________。
(2)下列气体能用浓硫酸干燥的是________。
A.NH3 B.HI C.SO2 D.CO2
(3)请用一个实验事实说明钠与镁的金属性强弱________________________________。
(4)KClO3可用于实验室制O2,若不加催化剂,400 ℃时可分解生成两种盐,化学方程式为:KClO3 ![]() KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
KCl+KClO4 (未配平),则氧化产物与还原产物的物质的量之比为_________。
(5)已知:
化合物 | MgO | MgCl2 |
类型 | 离子化合物 | 离子化合物 |
熔点/℃ | 2800 | 714 |
工业上电解MgCl2制单质镁,而不电解MgO的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. pH<7的降雨是酸雨
B. 氯气泄漏后应顺风向低处跑
C. SO2与水反应生成硫酸
D. 我国城市环境中的大气污染物主要有SO2、NO2、CO、可吸入颗粒物等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·黑龙江省牡丹江市第一高级中学月考)用98%的浓硫酸(ρ=1.84 g/cm3)配制1 mol/L稀硫酸100 mL。
(1)实验操作:
a.用100mL量筒量取98%的浓硫酸___________mL;
b.选取对应规格的容量瓶,洗涤,检查是否漏液,将稀释并冷却至室温的硫酸溶液沿玻璃棒转移到此容量瓶中;
c.用少量蒸馏水洗涤小烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中;
d.在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌;
e.向容量瓶中直接加蒸馏水至离刻度线1~2 cm处;
f.盖上容量瓶瓶塞,摇匀;
g.用胶头滴管小心加蒸馏水至刻度线;
h.将配制好的溶液转移入含少量蒸馏水的试剂瓶中贮存备用。
(2)实验分析:
①正确的操作步骤是__________________________________________________(填序号)。
②此实验中玻璃棒的作用是__________________________________________________。
③实验操作中有两处错误,这两处错误是:________________________、_________________________。
(3)下列操作对所配溶液的浓度有何影响?(填“偏高”“偏低”或“无影响”)
①量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中______________。
②定容时俯视容量瓶刻度线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物种类繁多的主要原因是 ( )
A. 有机物的分子结构十分复杂
B. 碳原子能与其他原子形成四个共价键,且碳原子之间也能互相成键
C. 有机物除含碳元素外,还含有其他多种元素
D. 自然界中存在多种形式的、大量的有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置进行相应的实验,不能达到实验目的的是

A. 利用图甲装置,可快速制取氨气
B. 利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液
C. 利用图丙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化
D. 利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 铵盐氮肥不能与碱性肥料草木灰混合施用
B. NH4Cl和NaCl的固体混合物可用升华法分离
C. 工业上合成氨属于人工固氮
D. 所有铵盐都易溶于水,铵根离子中的N均呈-3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据杂化轨道理论判断下列分子的空间构型是V形的是_____(填序号)。
a . BeCl2 b . H2O c . HCHO d . CS2
(2)己知AlCl3的沸点:1 90 ℃ (2.5个大气压),但是它在178 ℃ 就开始升华,则AlCl3的晶体类型为_______;为什么工业上一般不采用电解熔融氯化铝的方法制备金属铝________。 (3)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T 比Q 多2。T的基态原子外围电子(价电子)排布式为__________, Q2+的未成对电子数是______。
(4)下图是从NaCl或CsCl晶体结构图中分割出来的部分结构图,判断NaCl晶体结构的图象是下图中的_______(填序号)。

(5)[Cu(NH3)4]2+配离子中存在的化学键类型有_______(填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
已知:[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3 被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________。
(6)X与Y可形成离子化合物,其晶胞结构如图所示,其中X和Y的相对原子质量分别为a 和b,晶体密度为pg · cm-3,则晶胞中距离最近的X、Y之间的核间距离是_____cm 。( NA表示阿伏伽德罗常数,用含p、a、b、N的代数式表达)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是无机物A~F在一定条件下的转化关系(部分产物及反应条件未标出)。其中A为气体,A~F 都含有相同的元素。
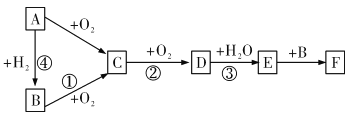
试回答下列问题:
(1)写出下列物质的化学式:C_______、F_______。
(2)在反应①中,34gB发生反应后放出452.9kJ的热量,请写出该反应的热化学方程式________。
(3)③的化学方程式为__________,该反应氧化剂与还原剂的物质的量之比为______。
(4)铜与E的浓溶液反应的离子方程式为__________ 。
(5)25.6g铜与含有1.4molE的浓溶液恰好完全反应,最终得到气体的体积为(标准状况下)__________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com