
【题目】有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为__;D的价电子排布图为__;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是__(填写分子的化学式); 在③的分子中有__个σ键和__个π键.
(3)A,C,D可形成既具有离子键又具有共价键的化合物,其化学式可能为__;足量的C的氢化物水溶液与CuSO4溶液反应生成的配合物,其化学式为__,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况:__.
【答案】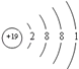
![]() NH3、CH4、H2S 5 1 NH4HS或(NH4)2S [Cu(NH3)4]SO4 内界中铜离子与氨分子之间以配位键相结合,外界铜氨络离子与硫酸根离子之间以离子键相结合
NH3、CH4、H2S 5 1 NH4HS或(NH4)2S [Cu(NH3)4]SO4 内界中铜离子与氨分子之间以配位键相结合,外界铜氨络离子与硫酸根离子之间以离子键相结合
【解析】
由于A,B,C,D为短周期元素,因A元素的周期数、主族数、原子序数相同,则A只能为氢元素;同一能层的不同能级的能量不同,符号相同的能级处于不同能层时能量也不同,即1s、2s、2p的轨道能量不同,2p有3个能量相同的轨道,由此可确定B;因s轨道最多只能容纳2个电子,所以c=2,即C原子价电子构型为2s22p3,即氮元素。短周期中原子的次外层只可能是K或L层,K、L层最多容纳2个或8个电子,据此可确定D。再由D的阴离子电子数及在E2D中E的化合价,即可确定E。由此分析。
由于A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同,则A为氢元素;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同,则B的电子排布式为1s22s23p2,即B为碳元素;因s能级最多只能容纳2个电子,即c=2,所以C原子价电子构型为2s22p3,C为氮元素;短周期中原子的次外层只可能是K或L层,K、L层最多容纳2个或8个电子,因D原子最外层电子数比次外层电子数少2个,所以D的次外层只能是L层,D的最外层应为6个电子,即D为16号元素硫;硫元素的阴离子(S2-)有18个电子,E阳离子也应有18个电子,在E2D中E显+1价,所以E为19号元素钾。所以A、B、C、D、E分别为氢、碳、氮、硫、钾。
(1)上述五种元素中金属性最强的是钾元素,故它的第一电离能最小,其原子结构示意图为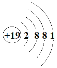 。硫原子价电子层为M层,价电子排布式为3s23p4,其电子排布图为
。硫原子价电子层为M层,价电子排布式为3s23p4,其电子排布图为![]() 。
。
(2)①分子结构图中黑点表示的原子最外层有5个电子,显然是氮原子,白球表示的原子最外层只有1个电子,是氢原子,所以该分子是NH3,中心N原子有3个σ键,1个孤电子对,故采用sp3杂化;②分子中黑球表示的原子最外层4个电子,是碳原子,白球表示的原子的最外层只有1个电子,是氢原子,所以②分子是CH4,中心碳原子有4个σ键,0个孤电子对,采用sp3杂化;③分子中黑球表示的原子最外层4个电子,是碳原子,白球表示的原子的最外层只有1个电子,是氢原子,所以③分子是CH2=CH2,中心碳原子有3个σ键,0个孤电子对,所以中心原子采用sp2杂化;④分子中黑球表示的原子最外层6个电子,是硫原子,白球表示的原子的最外层只有1个电子,是氢原子,该分子为H2S,中心S原子有2个σ键,2个孤电子对,所以中心原子采用sp3杂化。因此中心原子采用sp3杂化形成化学键的分子有NH3、CH4、H2S。在CH2=CH2的分子中有5个σ键和1个π键。
(3)根据上面的分析知A、C、D分别为氢、氮、硫三种元素,形成既具有离子键又具有共价键的化合物是硫氢化铵或硫化铵,其化学式为NH4HS或(NH4)2S,铵根与HS-或S2-之间是离子键,铵根中的N与H之间是共价键,HS-中H与S之间是共价键。C的氢化物是NH3,NH3的水溶液与CuSO4溶液反应生成的配合物是硫酸四氨合铜,其化学式为[Cu(NH3)4]SO4。配合物[Cu(NH3)4]SO4的内界中Cu2+与NH3之间是以配位键相结合,外界铜氨配离子[Cu(NH3)4]2+与硫酸根离子之间是以离子键相结合。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值,下列判断正确的是( )
A.标准状况下,22.4 L CCl4 含有的碳原子数是 NA
B.56 g Fe 与足量稀盐酸反应转移的电子数为 3 NA
C.0.1 mol/L Na2SO4 溶液含有的钠离子数为 0.2 NA
D.常温常压下,2g H2 中含有的分子数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料的中间体。由芳香化合物A制备H的一种合成路线如下:

已知:①
②![]()
回答下列问题:
(1)A的化学名称是______________,E中含有的官能团的名称为______________。
(2)B的结构简式为______________,由D到E的反应类型为______________。
(3)由E生成F的化学方程式为______________________________。
(4)G的结构简式为____________________。
(5)同时满足下列条件的F的一种同分异构体的结构简式为____________________。
①与FeCl3溶液显紫色
②能发生银镜反应
③核磁共振氢谱为五组峰,峰面积比为4:2:2:1:1
(6)设计由甲醛和乙醛为起始原料制备化合物C(CH2ONO2)4的合成路线:____________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于![]() (一种固体催化剂)合成
(一种固体催化剂)合成![]() 的原理示意图如图。下列说法错误的是
的原理示意图如图。下列说法错误的是

A. 氧化剂与还原剂的物质的量之比为3:1
B. 该过程中涉及极性键和非极性键的断裂与生成
C. 基于![]() 合成
合成![]() 的过程属于氮的固定
的过程属于氮的固定
D. 工业中,氨经一系列反应可以得到硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为____;基态Cu+的核外电子排布式为 ___。
(2)化合物(CH3)3N分子中N原子杂化方式为 ___,该物质能溶于水的原因是 ___。
(3)PH3分子的键角小于NH3分子的原因是 ___;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式 为____。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:

①在一个晶胞中磷原子的配位数为____。
②已知磷化硼晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则B-P键长为____pm。
③磷化硼晶胞沿着体对角线方向的投影如图2,请在答题卡上将表示B原子的圆圈涂黑________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年,元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。

(1)元素Ga在元素周期表中的位置为:___(写明周期和族)。
(2)Sn的最高正价为___,Cl的最高价氧化物对应水化物的化学式为___,As的气态氢化物为___。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是___(填化学式)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4___H2SeO4(填“>”、“<”或“=”)。
③氢化物的还原性:H2O___H2S(填“>”、“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找___(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)①Se2Cl2常用作分析试剂,其电子式为___。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是___(填字母)。
A.原子半径:In>Se
B.In的金属性比Se强
C.In的金属性比Al弱
D.硒化铟的化学式为InSe2
③工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为___。
(6)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
实验步骤 | 实验现象与结论 |
在试管中加入___,再加入___,将生成气体通过___洗气后,通入___; | 现象:___;结论:非金属性C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大,a和b的最外电子数之和等于c和d的最外层电子数之和,这四种元素组成两种盐b2da3和bca2。在含该两种盐的混合溶液中滴加盐酸,产生白色沉淀的物质的量与盐酸体积的关系如图所示。下列说法正确的是

A. 1mol d的氧化物含2mol 化学键
B. 工业上电解c的氧化物冶炼单质c
C. 原子半径:a < b < c < d
D. 简单氢化物的沸点:a < d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究SO2的化学性质,设计了如图系列实验。

(1)①中开始时无现象,放置一段时间后,出现白色浑浊,写出有关的三个反应的化学方程式:___、___、___;
(2)③中发生反应后的铁元素的价态为___。
(3)试写出④⑤中反应的离子方程式:___、___。
(4)若通入的气体改为CO2,那么①②③④中哪个会出现与SO2不同的现象?___(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年,一些药物引起的不良反应引起了人们的关注。因此在开发新药时如何减少毒副作用是一个很重要的课题。在下列结构简式中,Ⅰ是扑热息痛,Ⅱ是阿司匹林,它们都是临床应用广泛的解热镇痛药,但Ⅰ易导致肾脏中毒,Ⅱ对胃黏膜有刺激性,多用会引起胃溃疡。Ⅲ是扑炎痛,它是根据药物合成中“拼合原理”的方法,设计并合成出的解热镇痛药。这三种物质的结构简式如下:

试回答:
(1)为什么阿司匹林会有上述的毒副作用?___________
(2)合成扑炎痛的反应属于有机化学中的哪一类反应?_________
(3)扑炎痛本身并无解热镇痛的功效,但口服进入人体内后会产生上述药理作用,且毒副作用没有Ⅰ和Ⅱ那么明显,试加以解_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com