
【化学选修3:物质结构与性质】(15分)
(1)美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型。多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是 。
A、NO2-和NH4+ B、H3O+和ClO3- C、NO3-和CO32- D、PO43-和SO42-
(2)铜、锌两种元素的第一电离能、第二电离能如表所示
电离能/kJ·mol-1 | I1 | I2 |
铜 | 746 | 1958 |
锌 | 906 | 1733 |
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是 。
(3)石墨烯是从石墨材料中剥离出来、由碳原子组成的只有一层原子厚度的二维晶体。其结构如图:

有关说法正确的是
A、固态时,碳的各种单质的晶体类型相同 B、石墨烯中含有非极性共价键
C、从石墨中剥离石墨烯需要破坏化学键 D、石墨烯具有导电性
(4)最近科学家成功以CO2为原料制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以4个共价单键与氧原子结合为一种空间网状的无限延伸结构,则该晶体中碳原子采用 杂化与周围氧原子成键;晶体中碳氧原子个数比为 ;碳原子数与C-O化学键数之比为 。
(5)已知钼(Mo)的晶胞为体心立方晶胞,钼原子半径为a pm,相对原子质量为M,以NA表示阿伏伽德罗常数的值,请写出金属钼密度的计算表达式 g/cm3。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届重庆市高三上学期期中考试理综化学试卷(解析版) 题型:实验题
(14分)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。可用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为__________________________。
(2)检验TiO2·xH2O中Cl-是否被除净的方法是_____________________________。
(3)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是______________________;
使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的__________(填字母代号)。

(4)滴定终点的现象是____________________________。
(5)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样W g,消耗c mol·L-1NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为__________。
(6)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果__________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古奋斗中学高一上9月质检化学试卷(解析版) 题型:选择题
下列化学用语的书写,正确的是
A.氮气的电子式: B.甲烷的结构式:
B.甲烷的结构式:
C.溴化钠的电子式: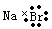 D.乙醇的分子式:CH3CH2OH
D.乙醇的分子式:CH3CH2OH
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆一中高一上学期10月月考化学试卷(解析版) 题型:填空题
(11分)(1)甲烷(CH4)的摩尔质量为______________;
(2)8g CH4中约含有______________个分子、含有______________mol电子,在标准状况下所占的体积约为______________L;
(3)所含氢原子数相等的甲烷和氨气(NH3)的质量比为______________。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期期中测试化学试卷(解析版) 题型:选择题
铁、铜混合粉末18.0g加入到100ml 5.0mol/LFeCl3溶液中,剩余固体质量为3.2g,下列说法正确的是
A.剩余固体是铁、铜混合物
B.反应后溶液中n(Fe2+)+ n(Cu2+)=0.75 mol
C.反应后溶液中n(Fe3+)=0.10 mol
D.原固体混合物中铜的质量是8.0g
查看答案和解析>>
科目:高中化学 来源:2016届湖北省、宜昌一中高三上10月联考化学试卷(解析版) 题型:选择题
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数之比为2:3:3,向溶液中通入氯气,使溶液中Cl-和Br-的个数比为7:3(已知还原性I->Fe2+>Br->Cl-),则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为
A.5:4 B.4:5 C.5:12 D.12:5
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江双鸭山第一中学高三上学期期中测试化学试卷(解析版) 题型:选择题
进行化学实验,观察实验现象,通过分析推理得以正确的结论是化学学习的方法之一。下列说法正确的是
A.浓硝酸在光照条件下变黄,说明浓硝酸不稳定生成的有色产物能溶于浓硝酸
B.在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应
C.氯化钠溶于水发生电离,电离方程式为:NaCl Na+ + Cl?,说明NaCl在通电条件下发生电离。
Na+ + Cl?,说明NaCl在通电条件下发生电离。
D.将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期期中测试化学试卷(解析版) 题型:实验题
(10分)某科研小组探究工业废Cu粉(杂质含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4·5H2O,实现废物综合利用,实验过程如下:
过程Ⅰ:

(1)废Cu粉中一定含有的杂质是 (填化学式)。
(2)分别写出过程②发生反应的离子方程式 。
过程Ⅱ:

(3)综合过程Ⅰ、II,计算废Cu粉中各成分的质量之比是 (化为最简单整数比)。
过程Ⅲ:已知25℃时:
电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶度积(Ksp) | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
(4)在Ⅱ中所得蓝色溶液中加入一定量的H2O2溶液,调节溶液的pH范围为 ,然后过滤、结晶,可得CuSO4·5H2O。
(5)下列与Ⅲ方案相关的叙述中,正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH选择的试剂可以是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在
查看答案和解析>>
科目:高中化学 来源:2016届四川省雅安市高三9月月考化学试卷(解析版) 题型:选择题
在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO完全沉淀;若加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为
A.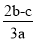 B.
B.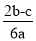 C.
C.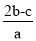 D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com