
| 方案序号 | 所用试剂 | 净化剂 | 干燥剂 |
| A | MnO2、稀盐酸 | 饱和食盐水 | 浓硫酸 |
| B | Ca(ClO)2、浓盐酸 | 饱和食盐水 | 无水硫酸铜 |
| C | 氯酸钾、浓盐酸 | 饱和碳酸钠溶液 | 浓硫酸 |
| D | KMnO4、浓盐酸 | 水 | 碱石灰 |
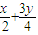 =
=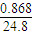
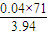 ×100%=72.08%
×100%=72.08%

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:阅读理解
 某课外活动小组做了如下关于钾的探究实验.
某课外活动小组做了如下关于钾的探究实验.| 方案序号 | 所用试剂 | 净化剂 | 干燥剂 |
| A | MnO2、稀盐酸 | 饱和食盐水 | 浓硫酸 |
| B | Ca(ClO)2、浓盐酸 | 饱和食盐水 | 无水硫酸铜 |
| C | 氯酸钾、浓盐酸 | 饱和碳酸钠溶液 | 浓硫酸 |
| D | KMnO4、浓盐酸 | 水 | 碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
。?
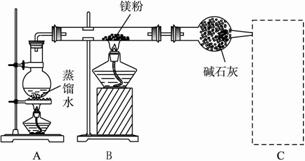
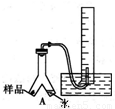
Ⅱ.若用灼热的镁粉与水蒸气反应,则在生成H2的同时还可能得到氧化镁粉末。为实现这一反应并收集一瓶H2,某课外活动小组设计了如图所示的装置。?
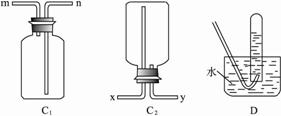
(1)若将装置C1与干燥管相连,则所连导管口应为 (填“m”或“n”);若将装置C2与干燥管相连,则所连导管口应为 (填“x”或“y”)。?
(2)实验开始时,应先点燃 (填“A”或“B”)处的酒精灯,等观察到 ,再点燃另一酒精灯。这样做的目的是 。?
(3)装置D的作用是检验集气瓶中是否收集满了H2,则检验的操作和需要观察的现象是 。?
(4)反应一段时间后,B装置玻璃管中可能残留的固体物质有(写化学式) 。任选其中一种,设计实验证明它的存在,简要写出主要操作、所用试剂、现象及结论。 。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.将刮去氧化膜的镁片投入沸水中,反应的化学方程式为 。
Ⅱ.若用灼热的镁粉与水蒸气反应,则在生成H2的同时还可能得到氧化镁粉未。为实现这一反应并收集一瓶H2,某课外活动小组设计了如图所示的装置。
(1)实验开始时,应先点燃 (填“A”或“B”)处的酒精灯,等观察到 ,再点燃另一酒精灯。这样做的目的是 。
(2)若将装置D与干燥管相连,则所连导管口应为 (填“m”或“n”),这种方法叫 (填“向上”、“向下”)排气法
(3)小试管C的作用是 。
(4)装置E的作用是检验集气瓶中是否收集满了H2,则检验的操作和需要观察的现象是 。
(5)反应一段时间后,B装置玻璃管中可能残留的固体物质除MgO外,还可能Mg和Mg(OH)2 任选其中一种,设计实验证明它的存在,简要写出主要操作.所用试剂.现象及结论。
查看答案和解析>>
科目:高中化学 来源:新课标2010-2011学年度上学期高三一轮复习单元测试3(新人教) 题型:实验题
Ⅰ.将刮去氧化膜的镁片投入沸水中,反应的化学方程式为 。
Ⅱ.若用灼热的镁粉与水蒸气反应,则在生成H2的同时还可能得到氧化镁粉未。为实现这一反应并收集一瓶H2,某课外活动小组设计了如图所示的装置。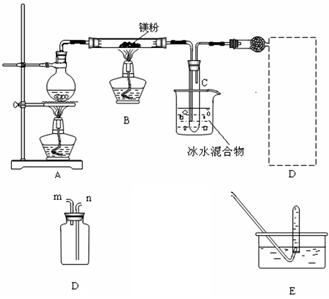
(1)实验开始时,应先点燃 (填“A”或“B”)处的酒精灯, 等观察到 ,再点燃另一酒精灯。这样做的目的是 。
等观察到 ,再点燃另一酒精灯。这样做的目的是 。
(2)若将装置D与干燥管相连,则所连导管口应为 (填“m”或“n”),这种方法叫 (填“向上”、“向下”)排气法
(3)小试管C的作用是 。
(4)装置E的作用是检验集气瓶中是否收集满了H2,则检验的操作和需要观察的现象是 。
(5)反 应一段时间后,B装置玻璃管中可能残留的固体物质除MgO外,还可能M
应一段时间后,B装置玻璃管中可能残留的固体物质除MgO外,还可能M g和Mg(OH)2 任选其中一种,设计实验证明它的存在,简要写出主要操作.所用试剂.现象及结论。
g和Mg(OH)2 任选其中一种,设计实验证明它的存在,简要写出主要操作.所用试剂.现象及结论。
查看答案和解析>>
科目:高中化学 来源:新课标2011届度上学期高三一轮复习单元测试3(新人教) 题型:实验题
Ⅰ.将刮去氧化膜的镁片投入沸水中,反应的化学方程式为 。
Ⅱ.若用灼热的镁粉与水蒸气反应,则在生成H2的同时还可能得到氧化镁粉未。为实现这一反应并收集一瓶H2,某课外活动小组设计了如图所示的装置。
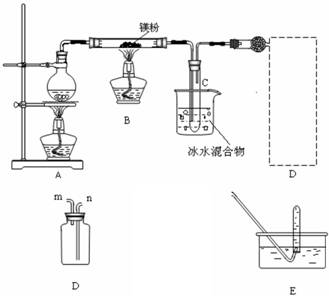
(1)实验开始时,应先点燃 (填“A”或“B”)处的酒精灯,等观察到 ,再点燃另一酒精灯。这样做的目的是 。
(2)若将装置D与干燥管相连,则所连导管口应为 (填“m”或“n”),这种方法叫 (填“向上”、“向下”)排气法
(3)小试管C的作用是 。
(4)装置E的作用是检验集气瓶中是否收集满了H2,则检验的操作和需要观察的现象是 。
(5)反应一段时间后,B装置玻璃管中可能残留的固体物质除MgO外,还可能Mg和Mg(OH)2 任选其中一种,设计实验证明它的存在,简要写出主要操作.所用试剂.现象及结论。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com