
| A.不能确定原气体中是否含有SO2 |
| B.原气体中肯定有HCl |
| C.原气体中肯定没有CO2 |
| D.原气体中肯定没有HBr、NO2 |
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:不详 题型:单选题
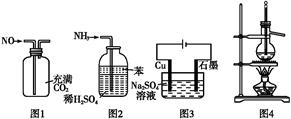
| A.用图1所示装置(正放)可收集NO气体 |
| B.用图2所示装置可吸收多余氨气且能防止倒吸 |
C.用图3所示装置可实现反应:Cu+2H2O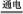 Cu(OH)2+H2↑ Cu(OH)2+H2↑ |
| D.用图4所示装置可分离乙醇(沸点78.4 ℃)与二甲醚(沸点24.9 ℃)的混合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 序号 | 实验内容 | 实验目的 |
| A | 室温下,使用pH计测定浓度均为0.1mol/L NaClO溶液CH3COONa | 比较HClO和CH3COOH的酸性强弱 |
| B | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制银氨溶液,水浴加热 | 检验蔗糖水解产物具有还原性 |
| C | 向新生成的AgCl悬浊液中滴入KI溶液 | 研究沉淀的转化 |
| D | 室温下,向两支装有同体积同浓度过氧化氢溶液的试管中,分别加入3滴同浓度的氯化铜、氯化铁溶液 | 研究催化剂对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X不一定含有SO42- |
| B | 向FeCl3+3KSCN Fe(SCN)3+3KCl溶液平衡体系中加入少量固体KCl Fe(SCN)3+3KCl溶液平衡体系中加入少量固体KCl | 体系颜色无变化] | KCl不能使该平衡移动 |
| C | 向浓度均为0. 1 mol·L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验操作 | 实验现象 | 实验结论 |
| A | 在铁粉和铝粉中加入过量的氢氧化钠溶液,完全反应后过滤 | 产生白色沉淀 | 可以除去铁粉中混有的少量铝粉 |
| B | 二氧化硫通入溴水中 | 溶液褪色 | 二氧化硫有漂白性 |
| C | 向某溶液中加入NaOH并微热 | 产生能够使湿润的红色石蕊试纸变蓝的无色气体 | 该溶液中一定含有N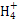 |
| D | 淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液 | 产生砖红色沉淀 | 淀粉水解可生成葡萄糖 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


| A.50 mL | B.100 mL | C.200 mL | D.250 mL |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作、现象 | 实验结论 |
| A | 将FeCl3溶液分别滴入NaBr、NaI溶液中,再分别滴加CCl4,振荡,静置 | 氧化性:Fe3+>Br2>I2 |
| B | 除锈的铁钉在浓硝酸中浸泡后,用蒸馏水洗净,再放入CuSO4溶液中无现象 | 铁钉表面形成了一层致密稳定的氧化膜 |
| C | 向某溶液中加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失 | 该溶液中有SO42- |
| D | 甲苯中滴入少量浓溴水,振荡,静置,溴水层褪色 | 萃取了浓溴水中的溴 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.用甲装置验证铜与稀硝酸的反应产物是NO |
B.通过乙装置实现化学反应: |
| C.用丙装置测定盐酸的浓度 |
| D.用丁装置检验溴乙烷与NaOH醇溶液共热有乙烯生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com