
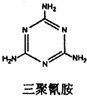
 “问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”.铬是严重的致癌物质,绝不允许含铬废水随意排放.请回答下列问题:
“问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”.铬是严重的致癌物质,绝不允许含铬废水随意排放.请回答下列问题: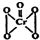 ,该反应可用来检验Cr2072-的存在.过氧化铬中铬元素的化合价为
,该反应可用来检验Cr2072-的存在.过氧化铬中铬元素的化合价为| 3 |
| ||
| 3 |
| ||
| 3 | 1×10-25 |
| KSPCr(OH)3 |
| C3(OH-) |
| 6.0×10-31 |
| 1×10-25 |


科目:高中化学 来源: 题型:
| A、“即热饭盒”的工作原理是将化学能转化为热能 |
| B、上述反应中,反应物的总能量大于生成物的总能量 |
| C、铁粉的作用是催化剂 |
| D、上述反应的反应热△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
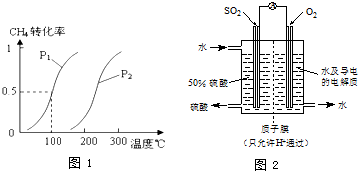
查看答案和解析>>
科目:高中化学 来源: 题型:
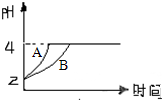 (1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈查看答案和解析>>
科目:高中化学 来源: 题型:
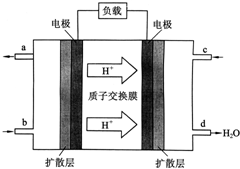 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化产物与还原产物物质的量比是3:1 | ||
B、被氧化的HCl占参加反应HCl总量的
| ||
| C、K37ClO3只有一部分发生还原反应 | ||
| D、反应完成后37Cl存在于KCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com