


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:
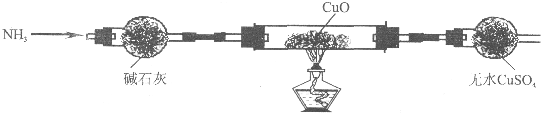
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)现有以下几种物质::①晶体二氧化硅②干冰③五氯化磷④金刚石⑤过氧化钠⑥冰⑦碳化硅⑧白磷;请用编号填写:通过非极性键形成原子晶体的是
(1)现有以下几种物质::①晶体二氧化硅②干冰③五氯化磷④金刚石⑤过氧化钠⑥冰⑦碳化硅⑧白磷;请用编号填写:通过非极性键形成原子晶体的是
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时甲、乙中C的体积分数甲>乙 |
| B、平衡时甲中A的转化率为60% |
| C、达到平衡后,再向乙中加入0.8molA+1.2molB+1.2molC,平衡向生成A的正向移动 |
| D、D甲容器达到平衡后,升温,反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
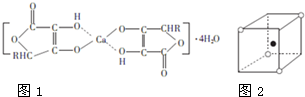 钙的化合物在共农业生产和生活中有广泛的应用.
钙的化合物在共农业生产和生活中有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池的电解质溶液为碱性溶液,正极为Ni2O3、负极为Fe |
| B、电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C、电池放电过程中,溶液中的OH-向负极移动 |
| D、电池放电与充电过程发生的化学反应是可逆反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com