
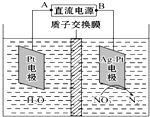
| A. | A为电源的正极 | |
| B. | 溶液中H+从阳极向阴极迁移 | |
| C. | 阴极反应式为2 NO3-+12H++10e-=N2↑+6H20 | |
| D. | 若电解过程中转移了2 mol电子,则左侧电解液的质量减少了16g |
分析 由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;阴极反应是NO3-得电子发生还原反应生成N2,转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,以此解答该题.
解答 解:A.该装置中,硝酸根离子得电子发生还原反应,则Ag-Pt电极为阴极、Pt电极为阳极,连接阴极的B电极为负极,A为正极,故A正确;
B.电解时阳离子向阴极移动,故B正确;
C.阴极上硝酸根离子得电子发生还原反应,电极反应式为2 NO3-+12H++10e-=N2↑+6H20,故C正确;
D.转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=18g-3.6g=14.4g,故D错误.
故选D.
点评 本题考查了电解原理,为高频考点,根据N元素化合价变化确定阴阳极、正负极,难点是电极反应式的书写,易错选项是D,注意氢离子还进入阴极室,很多同学往往只考虑析出的气体而导致错误,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 | |
| B. | 容量瓶、量筒和滴定管上都标有使用温度;量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| C. | pH计能用于酸碱中和滴定终点的判断 | |
| D. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
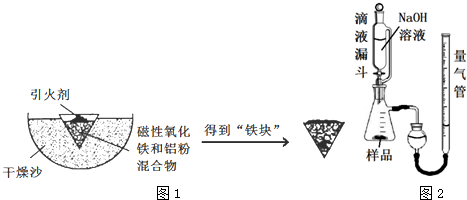
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
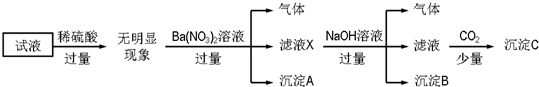
| A. | 沉淀A是BaSO4,说明原试液中一定含有SO42- | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe3+和Ba2+ | |
| C. | 沉淀C只有一种成分 | |
| D. | 原溶液中一定大量存在的离子只有:NH4+、Fe2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
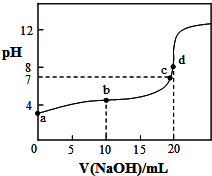 室温下,将0.1000mol/LNaOH溶液滴入20.00ml 0.1000mol/L CH3COOH溶液中,溶液pH随加入NaOH溶液体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将0.1000mol/LNaOH溶液滴入20.00ml 0.1000mol/L CH3COOH溶液中,溶液pH随加入NaOH溶液体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点:由水电离出的c(H+)=1.0×10-3mol/L | |
| B. | b点:c(CH3COO-)>c(CH3COOH)>c(Na+)>c(H+)>c(OH-) | |
| C. | c点:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| D. | d点:c(OH-)-c(H+)=c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.1mol/L氨水与0.1 mol/L稀盐酸等体积混合:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| B. | 将pH=2 的稀盐酸与pH=12的氨水等体积混合,所得溶液pH>7 | |
| C. | 0.10 mol•L-1的氨水用HNO3溶液完全中和后,溶液显中性 | |
| D. | 用惰性电极电解稀硫酸时,实质是电解水,溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质可以自由迁移,正极反应式为:MnO2+Li++e-=LiMnO2.回答下列问题:
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质可以自由迁移,正极反应式为:MnO2+Li++e-=LiMnO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
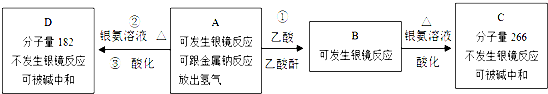
 、C
、C
 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$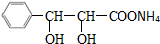 +3NH3+2Ag↓+H2O
+3NH3+2Ag↓+H2O (或
(或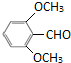 )
)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:S>Cl>F | B. | 碱性:NaOH>Mg( 0H)2>Al( 0H)3 | ||
| C. | 稳定性:PH3<H2S<HF | D. | 离子半径:02->Na+>Mg2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com