

分析 Ⅰ、(1)配制250mL溶液用到的仪器有托盘天平、药匙、玻璃棒、烧杯、250mL容量瓶、量筒(可用可不用),据此判断;
(2)步骤二中生成I2,加入淀粉,溶液呈蓝色,用Na2S2O3溶液滴定,I2反应完毕,溶液蓝色褪色;
(3)根据关系式KIO3~3I2~6Na2S2O3计算;
Ⅱ、(4)由题目信息可知,氯气在碱性溶液中氧化碘化物得到碘酸盐,由装置图可知,装置A为制备氯气,加热制备氯气,实验室通常用二氧化锰与浓盐酸加热反应生成氯化锰、氯气与水制备;
(5)浓盐酸具有挥发性,制备的氯气中含有HCl,影响C装置中的反应,装置B吸收HCl将其除去,通常用饱和食盐水吸收HCl,降低氯气的溶解;
(6)由题目信息可知,氯气在碱性溶液中氧化碘化物得到碘酸盐,故装置C中发生反应为氯气在碱性条件下氧化I-,生成氯离子、碘酸根与水;
(7)由于氯气有毒,直接排放到大气中,会污染大气,应在C之后添加尾气吸收装置,吸收氯气,防止污染大气.
解答 解:Ⅰ、(1)配制250mL溶液用到的仪器有托盘天平、药匙、玻璃棒、烧杯、250mL容量瓶、量筒(可用可不用),故还需要的玻璃仪器有:250mL容量瓶,
故答案为:250mL容量瓶;
(2)步骤二中生成I2,加入淀粉,溶液呈蓝色,用Na2S2O3溶液滴定,I2反应完毕,溶液蓝色褪色,
故答案为:溶液蓝色褪色;
(3)25mL溶液消耗Na2S2O3的物质的量为c mol•L-1×0.012L=0.012mol,故250mL溶液应消耗Na2S2O3的物质的量为0.012cmol×10=0.12cmol,令250mL溶液中KIO3的物质的量为xmol,则:
KIO3~~~~3I2~~~~6Na2S2O3
1 6
xmol 0.12cmol
所以x=0.02c
故加碘盐中KIO3的质量分数$\frac{0.02cmol×214g/mol}{ag}$×100%=$\frac{428c}{a}$%,
故答案为:$\frac{428c}{a}$%;
Ⅱ、(4)由题目信息可知,氯气在碱性溶液中氧化碘化物得到碘酸盐,由装置图可知,装置A为制备氯气,加热制备氯气,实验室通常用二氧化锰与浓盐酸加热反应生成氯化锰、氯气与水制备,装置A的反应离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(5)浓盐酸具有挥发性,制备的氯气中含有HCl,影响C装置中的反应,装置B吸收HCl将其除去,通常用饱和食盐水吸收HCl,降低氯气的溶解,
故答案为:饱和食盐水;
(6)由题目信息可知,氯气在碱性溶液中氧化碘化物得到碘酸盐,故装置C中发生反应为氯气在碱性条件下氧化I-,生成氯离子、碘酸根与水,反应离子方程式为3Cl2+I-+6OH-=6Cl-+IO3-+3H2O,
故答案为:3Cl2+I-+6OH-=6Cl-+IO3-+3H2O;
(7)由于氯气有毒,直接排放到大气中,会污染大气,应在C之后添加尾气吸收装置,吸收氯气,防止污染大气,
故答案为:缺少吸收氯气的尾气吸收装置.
点评 本题考查了氧化还原滴定的应用、对实验原理理解与实验装置的评价、阅读获取信息的能力,题目难度中等,是对知识的综合运用与分析解决问题能力的考查,注意基础知识的掌握.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
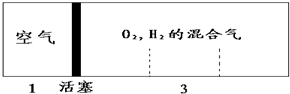 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )| A. | 2:7 | B. | 4:5 | C. | 5:4 | D. | 7:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  和 和 互为同分异构体 互为同分异构体 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,能说明侧链对苯环性质有影响 | |
| C. |  分子中所有碳原子可能都共面 分子中所有碳原子可能都共面 | |
| D. | 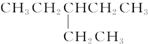 的核磁共振氢谱有5个峰 的核磁共振氢谱有5个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肥皂水遇Ca2+、Mg2+ 含量较高的水有白色沉淀生成 | |
| B. | 水稻田使用NH4NO3的肥效较差 | |
| C. | 肾功能衰竭等疾病引起的血液中毒,要利用血液渗析进行治疗,渗析原理与胶体的渗析类似 | |
| D. | 在冶金厂和水泥厂常用高压电对气溶胶作用以除去大量烟尘,减小对空气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属与盐溶液的反应都是置换反应 | |
| B. | 阴离子都只有还原性 | |
| C. | 离子化合物中肯定存在离子键,可能不存在共价键 | |
| D. | 与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与SO2反应生成Na2SO3和O2 | |
| B. | Na2O2投入到酚酞溶液中,溶液变红 | |
| C. | Na2O2与水反应,Na2O2既是氧化剂,又是还原剂 | |
| D. | Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种实验方案中都能制得纯净的铜 | |
| B. | 甲方案中的反应涉及置换、分解、复分解三种反应类型 | |
| C. | 乙方案中加过量铁粉只能还原其中的二种阳离子 | |
| D. | 丙方案不会产生环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验②中发生反应的离子方程式为:Fe2++Cl2═Fe3++2Cl-;Fe3++3SCN-═Fe(SCN)3 | |
| B. | 通过上述实验可确定该化合物的化学式为:(NH4)2Fe(SO4)2•6H2O | |
| C. | 只做实验①③④,也能达到实验目的 | |
| D. | 为了检验SO42-,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com