
【题目】X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.
请回答下列问题:
(1)X2分子中σ键和π键数目比是 .
(2)R的晶胞结构如图所示,该晶胞中所含的原子个数是 . 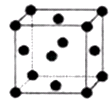
(3)下列有关X、Y、W的说法正确的是 .
①X的第一电离能在同族元素中最小
②常温下,Y的氢化物分子间存在氢键
③XY3﹣中X的杂化轨道类型为sp3杂化
④W属于d区的元素
(4)将X的气态氢化物的水溶液滴入R的氢氧化物悬浊液中,可得深蓝色溶液,该反应的离子方程是 .
(5)将Na2Y2与W2+的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,该反应的离子方程式是 .
(6)与X3﹣互为等电子体的分子有、离子有 .
【答案】
(1)1:2
(2)4
(3)②④
(4)Cu(OH)2+4NH3 . H2O=[Cu(NH3)4]2++2OH﹣+4H2O
(5)4Na2O2+Fe2++6H2O=4Fe(OH)3↓+O2↑+8Na+
(6)N2O或CO2或CS2或BeCl2;SCN﹣或OCN﹣或CNO﹣
【解析】解:X、Y、Z、W、R均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,即核外电子数为7,则X为N元素;W3+的基态离子3d轨道为半充满状态,离子核外电子排布为1s22s22p63s23p63d5 , 则W原子核外电子数为23+3=26,故W为Fe;R的氢氧化物悬浊液可用于检验葡萄糖的存在,则R为Cu;Y原子最外层有2对成对电子,外围电子排布为ns2np4 , 处于ⅥA族,Z的原子序数为Y的原子序数的2倍,结合原子序数可知,Y为O元素、Z为S元素。
(1.)N2分子结构式为N≡N,分子中σ键和π键数目比=1:2,所以答案是:1:2;
(2.)R原子处于晶胞的面心及顶角,该晶胞中所含的原子个数=6× ![]() +8×
+8× ![]() =4,所以答案是:4;
=4,所以答案是:4;
(3.)①X为N元素,其第一电离能在同族元素中最大,故①错误;②氧元素的氢化物为水或过氧化氢,常温下,分子间存在氢键,故②正确;③NO3﹣中N原子价层电子对数=3+ ![]() =3,N原子的杂化轨道类型为sp2杂化,③错误;④W为Fe,外围电子排布为3d64s2 , 属于d区的元素,故④正确,所以答案是:②④;
=3,N原子的杂化轨道类型为sp2杂化,③错误;④W为Fe,外围电子排布为3d64s2 , 属于d区的元素,故④正确,所以答案是:②④;
(4.)氨水滴入氢氧化铜悬浊液中,可得深蓝色溶液,该反应的离子方程是Cu(OH)2+4NH3 . H2O=[Cu(NH3)4]2++2OH﹣+4H2O,所以答案是:Cu(OH)2+4NH3 . H2O=[Cu(NH3)4]2++2OH﹣+4H2O;
(5.)将Na2O2与Fe2+的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,该反应的离子方程式是4Na2O2+Fe2++6H2O=4Fe(OH)3↓+O2↑+8Na+ , 所以答案是:4Na2O2+Fe2++6H2O=4Fe(OH)3↓+O2↑+8Na+;
(6.)X为N元素,N3﹣含有3个原子,电子数为22,互为等电子体的分子有N2O或CO2或CS2或BeCl2、离子有 SCN﹣或OCN﹣或CNO﹣ , 所以答案是:N2O或CO2或CS2或BeCl2; SCN﹣或OCN﹣或CNO﹣ .


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中进行反应A(s)+2B(g)![]() C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是( )
C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是( )
①混合气体的密度不变
②容器内气体的压强不变
③混合气体的总物质的量不变
④B的物质的量浓度不变
⑤v正(C)=v逆(D)
⑥v正(B)=2v逆(C)
A. ①④⑤⑥ B. ②③⑥ C. ②④⑤⑥ D. 只有④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计能够成功的是( )
A.检验亚硫酸钠试样是否变质:试样 ![]()
![]() 白色沉淀
白色沉淀 ![]() 沉淀不溶解→说明试样已变质
沉淀不溶解→说明试样已变质
B.除去粗盐中含有的硫酸钙杂质:粗盐 ![]()
![]()
![]()
![]()
![]()
![]() 精盐
精盐
C.检验某溶液中是否含有Fe2+:试样 ![]() 溶液颜色无变化
溶液颜色无变化 ![]() 溶液变红色→溶液中含有Fe2+
溶液变红色→溶液中含有Fe2+
D.证明酸性条件H2O2的氧化性比I2强:NaI溶液 ![]()
![]() 溶液变紫色→氧化性:H2O2>I2
溶液变紫色→氧化性:H2O2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用Na2CO3和NaHCO3溶液进行如图所示实验。下列说法中,正确的是
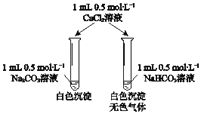
A. 实验前两溶液的pH相等 B. 实验前两溶液中离子种类完全相同
C. 加入CaCl2溶液后生成的沉淀一样多 D. 反应的离子方程式都是CO32-+Ca2+═CaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子晶体晶胞结构如图所示,X位于立方体的顶点,Y位于立方体中心.试分析: 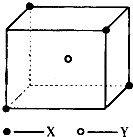
(1)晶体中每个Y同时吸引着个X,每个X同时吸引着个Y,该晶体的化学式为 .
(2)晶体中在每个X周围与它最接近且距离相等的X共有个.
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用.例如:计算机芯片的主要成分是________;光导纤维的主要成分是________; 人们使用量最大的传统硅酸盐产品有水泥、玻璃和________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( ) 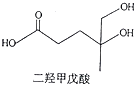
A.与乙醇发生酯化反应生成产物的分子式为C8H18O4
B.能发生加成反应,不能发生取代反应
C.在铜的催化下与氧气反应的产物可以发生银镜反应
D.标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活、科技、环境等密切相关,下列说法正确的是:
A. 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,其中的硝是指硝酸
B. 可以用氢氧化钠鉴别地沟油和矿物油
C. 用漂白精和洁厕灵(主要成分是盐酸)混合后的浓溶液清洗马桶效果更好
D. 明矾可以用于海水提纯制淡水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com