
若NA表示阿伏加德罗常数,下列有关叙述正确的是
A.标准状况下,44.8L苯中分子数为2NA
B.1mol水中含氢离子数为NA
C.5.6g铁与足量稀硫酸完全反应失去电子数为0.3NA
D.16 g CH4与18 g NH4+ 所含电子数均为10NA
科目:高中化学 来源: 题型:
某些芳香族化合物的分子式均为C7H8O,其中与FeCl3溶液混合后,显紫色和不显紫色的种类分别为
A、2种和1种 B、2种和3种 C、3种和2种 D、3种和1种
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下图,下列判断中正确的是( )

A.烧杯a中的溶液pH降低
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为2H++2e-===H2↑
D.烧杯b中发生的反应为2Cl--2e-===Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+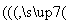 2Pb2++2H2O
2Pb2++2H2O
下列有关新型液流式铅酸蓄电池的说法不正确的是( )
A.放电时,蓄电池由化学能转化为电能
B.充放电时,溶液的导电能力变化不大
C.放电时的负极反应式为Pb-2e-===Pb2+
D.充电时的阳极反应式为Pb2++4OH-+2e-===PbO2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)铁是用途最广的金属材料之一,但生铁易生锈。请讨论电化学实验中有关铁的性质。
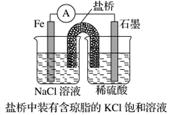
①某原电池装置如图所示,上图右侧烧杯中的电极反应式为____________,左侧烧杯中的c(Cl-)____________(填“增大”、“减小”或“不变”)。
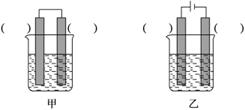
②已知下图甲、乙两池的总反应式均为Fe+H2SO4===FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料(填“Fe”或“C”)。
(2)用高铁(Ⅵ)酸盐设计的高铁(Ⅵ)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应为3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH。
①写出正极反应式:____________________________________________________。
②用高铁(Ⅵ)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当电池中有0.2 mol K2FeO4反应时,则在电解池中生成H2________ L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列鉴别方法可行的是
A.用氨水鉴别Al3+、Mg2+和Ag+ B.用盐酸酸化的BaCl2溶液鉴别Cl-、SO 和CO
和CO
C.用溴水鉴别CH4和C2H4 D.用KMnO4酸性溶液鉴别CH3CH2OH和CH3CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物在国民经济的发展中起着重要作用。
(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1641.0 kJ·mol-1
C(石墨)+1/2O2(g)=CO(g) △H=-110.5 kJ·mol-1
则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的△H= kJ·mol-1。
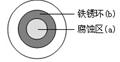 (2)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色 (b),如右图所示。液滴中心是 区(填“正极”或“负极”),其电极反应式为 。为减缓钢铁的腐蚀,可与锌块相连,该方法称为 。
(2)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色 (b),如右图所示。液滴中心是 区(填“正极”或“负极”),其电极反应式为 。为减缓钢铁的腐蚀,可与锌块相连,该方法称为 。
(3)铁钛合金是一种不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O= TiO2+(无色)+Fe2++2H+
③ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在一密闭容器中将1.0 mol/L N2与3.0 mol/L H2合成氨,反应到2s时测得
NH3的浓度为0.8 mol/L,用N2浓度的变化量来表示该反应速率时,该反应的反应速率为
A、0.2 mol/(L·s) B、0.4 mol/(L·s) C、0.6 mol/(L·s) D、0.8 mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com