
| A. | 30% | B. | 50% | C. | 70% | D. | 90% |
分析 ag铁粉和铝粉的混合物,溶于足量盐酸后生成氯化铁和氯化铝,再加入过量氢氧化钠溶液得到的沉淀为氢氧化铁;将氢氧化铁完全灼烧后最终应生成agFe2O3,则铝的质量等于Fe2O3中O元素的质量,以此计算原混合物中铝粉的质量分数.
解答 解:ag铁粉和铝粉的混合物,溶于足量盐酸后生成氯化铁和氯化铝,再加入过量氢氧化钠溶液得到的沉淀为氢氧化铁;
将氢氧化铁充分灼烧后最终应生成的是Fe2O3,质量为ag,则铝的质量等于Fe2O3中O元素的质量,
则原混合物中铝粉的质量分数为:$\frac{3×16}{3×16+2×56}$×100%=30%,
故选A.
点评 本题考查混合物反应的计算,题目难度中等,明确原混合物中Al的质量等于最终得到的氧化铁中氧元素质量为解答关键,试题培养了学生的分析能力及化学计算能力.


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠是银白色金属,密度很大 | |
| B. | 将金属钠放到水中不反应 | |
| C. | 金属钠在空气中燃烧,生成过氧化钠 | |
| D. | 金属钠的熔点很高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
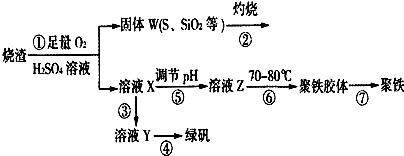
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3溶液(AgNO3):加过量KCl溶液,过滤 | |
| B. | NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热 | |
| C. | NaCl溶液(Br2):加CCl4,萃取分液 | |
| D. | KNO3溶液(NaCl):加热蒸发得浓溶液后,降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是只含有C、H、O、N四种元素的有机物的简易球棍模型,完成下列问题:
如图是只含有C、H、O、N四种元素的有机物的简易球棍模型,完成下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 炒过菜的铁锅不及时清洗易生锈 | |
| B. | 轮船吃水线以下的船壳外焊上锌块,可以防止铁船体被腐蚀 | |
| C. | 铁发生电化学腐蚀时铁为正极 | |
| D. | 经常用钢丝球擦洗铝锅表面,可以防止铝锅被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼的晶体类型.分子晶体
肼的晶体类型.分子晶体查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com