
镁、铝、铁及其化合物在生产、生活中有着广泛的应用
I:实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
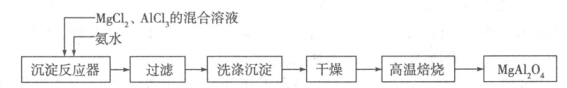
(1)已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34,该温度下向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成 沉淀(填化学式)。
(2)高温焙烧时发生反应的化学方程式 ,洗涤沉淀时的方法是 。
(3)常温下如果向AlCl3饱和溶液中不断通人HCl气体,可析出AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
Ⅱ:某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。
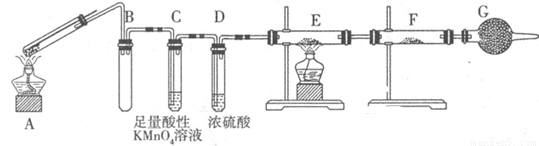
(1)G装置的作用是 。
(2)证明有SO2生成的现象是 ,为了证明气体中含有氢气,装置E和F中加入的试剂分别为 、 。
(3)若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体,原因是 。
I(1)Al(OH)3
(2)2Al(OH)3+Mg(OH)2=MgAl2O4+4H2O (2分) 向置于过滤器上的沉淀加蒸馏水至完全没过沉淀,待其自然流尽后,重复二到三次即可(2分)
(3)AlCl3饱和溶液中存在溶解平衡:AlCl3?6H2O(s)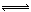 Al3+(aq)+3Cl?(aq)+6H2O(l),通入HCl气体使溶液中c(Cl?)增大,平衡向析出固体的方向移动从而析出AlCl3?6H2O晶体。(3分)
Al3+(aq)+3Cl?(aq)+6H2O(l),通入HCl气体使溶液中c(Cl?)增大,平衡向析出固体的方向移动从而析出AlCl3?6H2O晶体。(3分)
II(1)防止空气中的H2O进入F(2分)
(2)酸性高锰酸钾溶液褪色(2分) CuO、CuSO4(各1分)
(3)浓硫酸中的水很少(2分)
【解析】
试题分析:I(1)根据Ksp[Mg(OH)2]可求出Mg2+再转化为Mg(OH)2沉淀OH?浓度,c(Mg2+)?c2(OH?)=1.8×10-11,因为c(Mg2+)=1/2c(OH?),则1/2c3(OH?)=1.8×10-11, Ksp[Al(OH)3]=1/3 c4(OH?)=3×10-34,比较可得恰好生成Al(OH)3时,OH?浓度小,所以先生成Al(OH)3沉淀。
(2)根据流程图,高温焙烧时的反应物为Mg(OH)2和Al(OH)3,生成物为MgAl2O4和4H2O,配平可得化学方程式:2Al(OH)3+Mg(OH)2=MgAl2O4+4H2O;沉淀洗涤的方法为:向置于过滤器上的沉淀加蒸馏水至完全没过沉淀,待其自然流尽后,重复二到三次即可。
(3)AlCl3饱和溶液中存在沉淀溶解平衡:AlCl3?6H2O(s)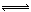 Al3+(aq)+3Cl?(aq)+6H2O(l),通入HCl气体使溶液中c(Cl?)增大,平衡向析出固体的方向移动从而析出AlCl3?6H2O晶体。
Al3+(aq)+3Cl?(aq)+6H2O(l),通入HCl气体使溶液中c(Cl?)增大,平衡向析出固体的方向移动从而析出AlCl3?6H2O晶体。
II(1)因为该实验要检验是否有H2O生成,所以装置G盛放物质为碱石灰,作用是防止空气中的H2O进入F。
(2)SO2具有还原性,能被酸性KMnO4溶液氧化,所以证明有SO2生成的现象是酸性高锰酸钾溶液褪色;为了证明气体中含有氢气,装置E和F中加入的试剂分别为CuO、CuSO4,若含有H2,H2可把CuO还原为Cu,生成的H2O能与CuSO4反应生成蓝色的CuSO4?5H2O。
(3)浓硫酸中的水很少,CuSO4没有溶解,以CuSO4固体的形式存在,为白色。
考点:本题考查化学流程的分析、化学方程式的书写、沉淀溶解平衡、化学实验方案的分析。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源:2013-2014学年广东省惠州市高三4月模拟考试理综化学试卷(解析版) 题型:填空题
氨的合成是最重要的化工生产之一。
I.工业上合成氨用的H2有多种制取的方法:
① 用焦炭跟水反应: C(s)+ H2O(g) 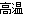 CO(g)+ H2(g);
CO(g)+ H2(g);
② 用天然气跟水蒸气反应:CH4(g)+ H2O(g) CO (g)+ 3H2(g)
CO (g)+ 3H2(g)
已知有关反应的能量变化如下图,则方法②中反应的ΔH =__________ ___。
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+ N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
容 器 | 甲 | 乙 | 丙 |
反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 |
达到平衡的时间(min) | t | 5 | 8 |
平衡时N2的浓度(mol·L-1) | c1 | 3 |
|
N2的体积分数 | ω1 | ω2 | ω3 |
混合气体密度(g·L-1) | ρ1 | ρ2 |
|
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min (填>、< 或=)
(3)乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4)分析上表数据,下列关系正确的是________.
a.2c1 =3mol/L b.ω1 = ω2 c.2ρ1 = ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=____ __(用分数表示)(mol/L)-2。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省十校联考高三下学期理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1molH2O2中含有的电子数为16NA
B.标准状况下,11.2L Br2中含Br—Br键数为0.5NA
C.1 mol Fe与足量稀HNO3反应,转移3 NA个电子
D.1 L 0.1 mol ·L-1NaHCO3溶液中含有0.1NA 个HCO3 —
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省文登市高三第三次统考理科综合化学试卷(解析版) 题型:填空题
镍、钴、铈、铬虽然不是中学阶段常见的金属元素,但在工业生产中有着重要的作用。
(1)二氧化铈 (CeO2)是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,H2O2在该反应中作_____(填“氧化”“还原”)剂,每有1mol H2O2参加反应,转移电子的物质的量为_____。
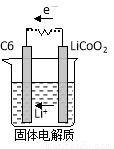
(2)某锂离子电池含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电极材料碳(C6)中,以LiC6表示,电池反应为LiCoO2+ C6 CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。
CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。
(3)自然界Cr主要以三价Cr和六价Cr的形式存在。六价Cr能引起细胞的突变和癌变。可以用亚硫酸钠将其还原为三价铬,完成并配平下列离子方程式:__Cr2O72-+__SO32-+__H+=__Cr3++__SO42-+ __ ____
(4)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等元素)为原料获得。操作步骤如下:
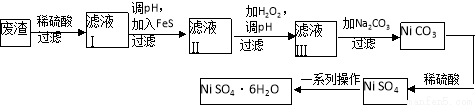
 向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,除去Cu2+的离子方程式为______________________。
向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,除去Cu2+的离子方程式为______________________。
②向滤液Ⅱ中加入H2O2,溶液中发生反应的离子方程式为__________________,调节pH的目的是______________________。
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4的目的是______________________。
④我国第五套人民币中的一元硬币材料为钢芯镀镍,镀镍时,镍应作_____极。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省文登市高三第三次统考理科综合化学试卷(解析版) 题型:选择题
X、Y、Z、W 属于同周期的短周期主族元素,原子序数依次增大,它们的原子最外层电子数之和为17,且Y原子最外层电子数是X原子最外层电子数的3倍,W的内层电子数比最外层电子数多。下列说法正确的是
A.原子半径大小:r(X)>r(Y);简单离子半径大小:r(W)>r(Z)
B.X、Y、Z最高价氧化物的水化物两两之间可以发生反应
C.氢化物的稳定性:W>Z;氧化物水化物的酸性:W>Z
D.甲物质由Y和Z元素组成,溶于水后得到甲的水溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三4月模拟考试(二模)理综化学试卷(解析版) 题型:选择题
某有机物的结构简式如图所示,下列说法正确的是
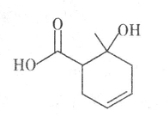
A.可使溴的四氯化碳溶液或酸性KMnO4溶液褪色
B.含有两种官能团
C.与乙酸互为同系物
D.可以发生取代反应和加成反应,但不能发生聚合反应
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市高三年级4月考理综化学试卷(解析版) 题型:填空题
下表为元素周期表的一部分:
族 周期 |
|
|
| |||||
1 | ① |
|
|
|
|
|
|
|
2 |
|
|
|
|
| ② |
|
|
3 | ③ |
|
| ④ |
| ⑤ | ⑥ |
|
Ⅰ.请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)写出元素②的离子结构示意图______________。
(2)②、③、⑤的离子半径由大到小的顺序为_________________________。
(3)元素④与⑥形成化合物的电子式是_________________________。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图所示的变化,其中A是一种淡黄色固体。请回答:
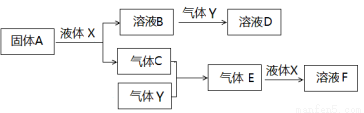
(4)写出固体A与液体X反应的离子方程式 。
(5)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1:1且恰好完全反应时,所得溶液D。已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为 。
(6)在500℃,101kPa时,气体C与气体Y反应生成0.2mol气体E时,放出akJ热量,写出该条件下反应的热化学方程式 。
(7)若气体C与Y在恒容绝热的条件下反应,下列说法能判断达到平衡状态的是 。
A.温度不变 B.气体总压强不变 C.混合气体的密度不变 D.混合气体的平均分子量不变
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:实验题
某些资料认为:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:
假设Ⅰ.过氧化钠氧化二氧化氮
假设Ⅱ.二氧化氮氧化过氧化钠
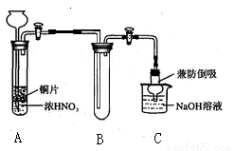
(1)小组甲同学设计实验如下:
①试管A中反应的化学方程式是 。
②待试管B中收集满气体,向试管B中加入适量 Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将余烬木条迅速伸进试管内,看见木条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,在A、B之间增加一个装置,该装置的作用是 。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;余烬木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的方程式是 。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:① 2NO+Na2O2=2NaNO2
②6NaNO2+3H2SO4=3Na2 SO4+ 2HNO3+4NO↑+2H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。
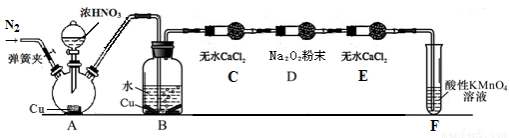
①B中观察到的主要现象是 ,F装置的作用是 。
②在反应前,打开弹簧夹,通入一段时间N2,目的是 。
③充分反应后,检验D装置中发生反应的实验是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市丰台区高三下学期统一练习(一)化学试卷(解析版) 题型:选择题
图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法不正确的是
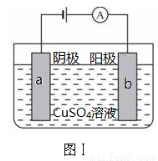
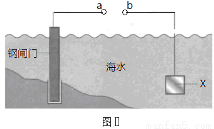
A.图Ⅰ中a为纯铜
B.图Ⅰ中SO42—向b极移动
C.图Ⅱ中如果a、b间连接电源,则a连接负极
D.图Ⅱ中如果a、b间用导线连接,则X可以是铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com