
| D的单质 |
| D的单质 |
| H2O |
| D的单质 |
| D的单质 |
| H2O |
| D的单质 |
| D的单质 |
| H2O |
 ,G为NH3,只含N-H共价键,为共价化合物,故答案为:
,G为NH3,只含N-H共价键,为共价化合物,故答案为: ;共价;
;共价; ,X是过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,其电子式为
,X是过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,其电子式为 ,故答案为:
,故答案为: ;
; ;
;
| ||
| ||
| ||
| ||
 ,故答案为:
,故答案为: ;
;
| ||
| ||


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
| A、金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物 |
| B、酸性氧化物都能与水化合生成酸 |
| C、碱性氧化物都能与水化合生成碱 |
| D、碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
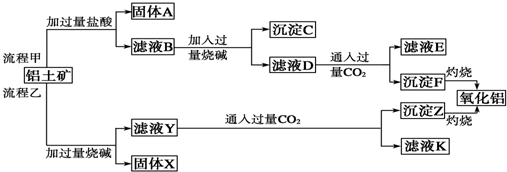

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡不移动 |
| B、混合气体的密度不变 |
| C、B的体积分数增大 |
| D、a mol/L<c(A)<2a mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 氧化剂 | 还原剂 | 其它反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
| ③ | KClO3 | HCl(浓) | Cl2 | Cl2 | |
| ④ | KMnO4 | HCl(浓) | Cl2 | MnCl2 |
| A、表中第①组反应的氧化产物中一定有FeCl3 |
| B、氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+ |
| C、还原性比较:H2O2>Mn2+>Cl- |
| D、④的离子方程式配平后,H+的化学计量数为16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al(OH)3、CaCO3都难溶,但溶解的部分都能完全电离 |
| B、复盐是纯净物,而混盐(如CaOCl2)是混合物 |
| C、弱电解质溶液中有溶质分子,但强电解质溶液中难以存在溶质分子 |
| D、电解质溶液能够导电,是因为通电使电解质电离产生了自由移动的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种溶液的pH不相同 |
| B、它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| C、分别用水稀释相同倍数时,n(Cl-)=n(CH3COO-) |
| D、它们分别与足量CaCO3反应时,放出的CO2一样多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com