
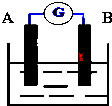
 如图为原电池装置示意图,
如图为原电池装置示意图,

科目:高中化学 来源: 题型:
| A、向NaClO溶液中通入少量二氧化硫 3ClO-+SO2+H2O═2HClO+SO42-+Cl- |
| B、碳酸氢钙与过量的NaOH溶液反应Ca2++HCO3-+OH-═CaCO3↓+H2O |
| C、用二氧化硫水溶液吸收溴蒸气:SO2+Br2+2H2O═SO42-+2H++2HBr |
| D、在碳酸氢铵稀溶液中加入足量的氢氧化钠稀溶液:NH4++OH-═NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①与②比较:c(Na+)>c(NH4+) |
| B、①中离子浓度的大小关系是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、①和②等体积混合的溶液中:c(Cl-)=c(Na+)+c(NH4+)+c(NH3?H2O) |
| D、向③中滴加适量醋酸溶液,使溶液pH=7,则:c(CH3COO -)>c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
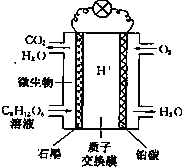 微生物燃料电池(MFC)是燃料电池中特殊的一类,它利用微生物作为反应主体.将有机物的化学能转化为电能.以葡萄糖溶液作底物为例,其工作原理如图所示.
微生物燃料电池(MFC)是燃料电池中特殊的一类,它利用微生物作为反应主体.将有机物的化学能转化为电能.以葡萄糖溶液作底物为例,其工作原理如图所示.| 序号 | A | B | C | D | E |
| 污水类型 | 生活污水 | 印染 | 电镀 | 造纸 | 硫酸工业废水 |
| COD值/mg?L-1 | 520 | 870 | 20 | 960 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com