
| A. | K2CO3 | B. | Na2SO4 | C. | Ca(OH)2 | D. | Na2CO3 |
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 糖类在一定条件下都可以水解生成乙醇和二氧化碳 | |
| B. | 乙酸乙酯和油脂都属于酯类物质,碱性条件水解称之为皂化反应 | |
| C. | 硝酸汞溶液加入到鸡蛋清中,可以使蛋清液盐析而沉淀下来 | |
| D. | 淀粉在稀硫酸加热催化下,水解产物葡萄糖的检出,先加入NaOH溶液后加入银氨溶液水浴加热,看是否有银镜出现.若出现银镜,证明有葡糖糖生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
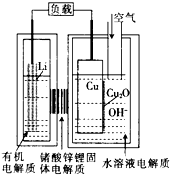 正在研制的一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
正在研制的一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 通空气时,铜被腐蚀,表面产生CuO | |
| B. | 放电一段时间后右侧水溶液电解质中LiOH浓度逐渐增大 | |
| C. | 放电时,正极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH- | |
| D. | 整个反应过程中,铜相当于催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
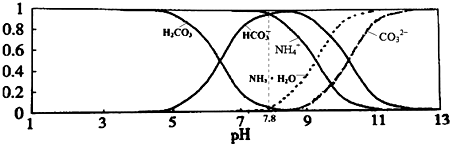
| A. | 当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3•H2O)>c(CO32-) | |
| B. | NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3•H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3) | |
| C. | 由图可知,往该溶液中逐滴滴加氢氧化钠时NH4+浓度逐渐减小,HCO3-浓度先增大后减小 | |
| D. | 通过分析可知常温下:Ka1(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 235g的${\;}_{92}^{235}U$发生裂变反应:${\;}_{92}^{235}$U+${\;}_0^1$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_0^1$n,净产生的中子(${\;}_0^1$n)数为10NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发FeCl3溶液,得到FeCl3固体 | |
| B. | 在FeCl3、CuCl2混合液中,加入少量Fe粉,一定有H2产生且有Cu析出 | |
| C. | 用FeCl3固体溶于水配制饱和溶液,会有Fe(OH)3沉淀产生 | |
| D. | 在FeCl3溶液中,加入KHCO3溶液,有CO2产生,但无Fe(OH)3沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com