
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:高中化学 来源: 题型:阅读理解
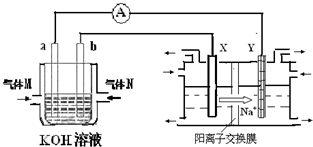 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.| 1 |
| 2 |
| 1 |
| 2 |
| 物质的量/(mol)/时间(h) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 |
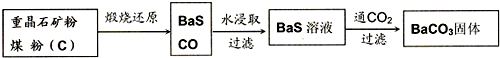
 HS-+OH-
HS-+OH- HS-+OH-
HS-+OH-查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 高温高压 |
| 时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源:中山模拟 题型:问答题
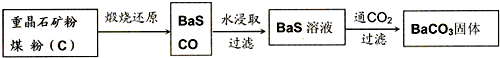
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2009年广东省中山市高考化学模拟试卷(解析版) 题型:解答题

 O2(g)=CO(g);△H=-110.5kJ?mol-1
O2(g)=CO(g);△H=-110.5kJ?mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com