
【题目】下列数据不一定随着温度升高而增大的是
A. 化学反应速率υ B. 化学平衡常数K
C. 弱电解质的电离平衡常数K D. 水的离子积常数Kw
科目:高中化学 来源: 题型:
【题目】将pH=5的H2SO4的溶液稀释1000倍后,溶液中SO42-离子浓度与H+离子浓度的比值约为
A.1:10 B.1:1 C.1:2 D.1:20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含0.78molFeCl2溶液中通入0.09molCl2, 再加入100mL1mol/L的X2O72-酸性溶液,使溶液中的Fe2+恰好全部氧化,则产物中X的化合价为 ( )
A.+3 B.+2 C.+1 D.+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4KJ/mol。在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图所示:
2NH3(g) ΔH=-92.4KJ/mol。在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图所示:
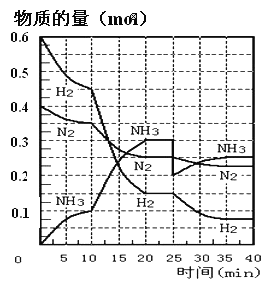
(1)10min内用NH3表示该反应的平均速率,v(NH3)= _______。
(2)在10-20min内NH3浓度变化的原因可能是_______(填字母)。
a.加了催化剂 b.降低温度 c.增加NH3的物质的量
(3)该可逆反应达到平衡的标志是___(填字母)
a.3v(H2)正=2v(NH3)逆
b.混合气体的密度不再随时间变化
c.容器内的总压强不再随时间而变化
d.N2、H2、NH3的分子数之比为1:3:2
e.单位时间生成mmolN2的同时消耗3mmolH2
f.amolN=N键断裂的同时,有6amolN-M键合成
(4)第一次平衡时,平衡常数K1=____(用数学表达式表示)。NH3的体积分数是_____(保留2位小数)。
(5)在反应进行到25min时,曲线发生变化的原因是______。
(6)已知:N2(g)+3H2![]() 2NH3(g) ΔH=-92.4KJ/mol
2NH3(g) ΔH=-92.4KJ/mol
2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6KJ/mol
2H2O(g) ΔH=-483.6KJ/mol
氨气完全燃烧生成气态水的热化学方程式是______
(7)安阳燃料电池具有很大的发展潜力。安阳燃料电池工作原理如图所示:
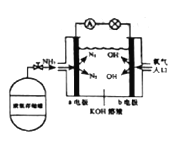
①b电极的电极反应式是_________;
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”。例如,如图有机物分子中带“*”碳原子就是手性碳原子。该有机物分别发生下列应,生成的有机物分子中仍含有手性碳原子的是

A. 催化剂作用下与H2反应
B. 与NaOH水溶液反应
C. 发生银镜反应
D. 与乙酸发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,不能按右图(“→”表示反应一步完成)关系转化的是
选项 | a | b | c |
|
A | Cu | CuO | Cu(OH)2 | |
B | SiO2 | Na2SiO3 | H2SiO3 | |
C | AlCl3 | NaAlO2 | Al(OH)3 | |
D | CaO | Ca(OH)2 | CaCO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组以一种工业废料制备高纯MgO,设计了流程如下。

请回答下列问题。
(1)步骤①中生成Mg2+的离子方程式为______________
(2)下列物质可用于代替步骤②中H2O2的是__________
A.NaCl B.Cl2 C.铁粉 D.KMnO4
(3)步骤③中采用如图所示装置除去Fe3+

ⅰ.实验装置图中仪器A的名称为________________
ⅱ.充分振荡并静置分层,打开仪器A上口的玻璃塞后,上、下层分离的正确操作是:________________
ⅲ.图中存在的错误是:________________
(4)步骤④中NaOH加入的量是______________ (填“少量”或“过量”)
(5)实验中,取工业废料40.0g( MgCO3的含量为42%),得到4.0g高纯氧化镁。该实验中高纯氧化镁的产率为____________(![]() )
)
(6)高纯氧化镁可能具有如下性质和用途,正确的是____________
A.耐酸 B.耐碱 C.制耐火坩埚 D.制信号弹和焰火材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时加水稀释10 mL pH=11的氨水,下列判断正确的是 ( )
A.原氨水的浓度为10-3mol·L-1
B.溶液中![]() 减小
减小
C.氨水的电离程度增大,溶液中所有离子的浓度均减小
D.再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com