
A、氨水中加酸,NH
| ||
| B、合成氨工业中不断从反应混合物中液化分离出氨气 | ||
| C、实验室中常用排饱和食盐水的方法收集Cl2 | ||
| D、合成氨控制在500℃左右的温度 |


科目:高中化学 来源: 题型:
| A、pH=5的盐酸,再加水冲稀1000倍,溶液的pH=8 |
| B、给稀醋酸溶液加热,溶液pH值增大 |
| C、pH=1的盐酸中c(H+)是pH=3的盐酸的c(H+)100倍 |
| D、在H2CO3溶液中,C(H+):C(CO32-)=2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2S是还原剂,O2是氧化剂 |
| B、Cu是还原产物,SO2是氧化产物 |
| C、1 mol Cu2S和O2反应生成2 mol Cu,转移电子数的物质的量为6 mol |
| D、反应消耗3 mol Cu2S时,被O2氧化的硫(S)的物质的量为3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4HCO3和盐酸的反应是放热反应 |
| B、反应的热化学方程式为:NH4HCO3+HCl═NH4Cl+CO2↑+H2O△H>0 |
| C、反应物的总能量高于生成物的总能量 |
| D、该反应中,热能转化为产物内部的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、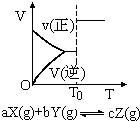 密闭容器中反应达到平衡,t0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂 |
B、 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应, 且a>b |
C、 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 |
D、 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体、D为固体或液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.6mol?L-1 |
| B、大于0.3 mol?L-1,小于0.6 mol?L-1 |
| C、大于0.6 mol?L-1 |
| D、小于0.3 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图Ⅰ配制1mol/L NaCl溶液定容操作 |
| B、图Ⅱa口进气可收集Cl2、CO2等气体 |
| C、图Ⅲ探究NaHCO3的热稳定性 |
| D、图Ⅳ蒸发结晶获得氯化钠晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、恒温恒容通入He |
| B、再通入少量CO2 |
| C、温度升高 |
| D、加压 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com