
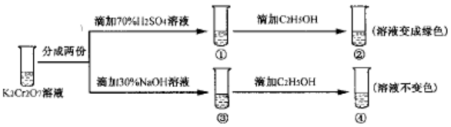
| A. | ①中溶液变黄,③中溶液橙色加深 | |
| B. | 上述可逆反应的平衡常数:①<③ | |
| C. | K2Cr2O7溶液的氧化性在酸性条件下更强 | |
| D. | 若向④中加入70%H2SO4溶液至过量,溶液变为橙色 |
分析 K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+,加入酸,氢离子浓度增大,平衡逆向移动,则溶液橙色加深,加入碱,平衡正向移动,溶液变黄,由实验②、④可知Cr2O72-具有较强的氧化性,可氧化乙醇,而CrO42-不能,以此解答该题.
解答 解:A.在平衡体系中加入酸,平衡逆向移动,重铬酸根离子浓度增大,橙色加深,加入碱,平衡正向移动,溶液变黄,故A错误;
B.平衡常数是温度的函数,温度不变,平衡常数不变,故B错误;
C.②是酸性条件,④是碱性条件,酸性条件下氧化乙醇,而碱性条件不能,说明酸性条件下氧化性强,故C正确;
D.若向④溶液中加入70%的硫酸到过量,溶液为酸性,可以氧化乙醇,溶液变绿色,故D错误.
故选C.
点评 本题综合考查氧化还原反应以及化学平衡的移动问题,侧重于学生的分析能力的考查,注意把握题给信息,为解答该题的关键,易错点为D,注意Cr2O72-、CrO42-氧化性的比较,难度不大.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH<7 | B. | 得到澄清透明溶液 | ||
| C. | 得到浑浊液 | D. | 先有白色沉淀生成,后逐渐溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “化学--人类进步的关键”.化学在生产生活中有着广泛的运用,尤其是化学反应原理.人们平时所用的铁及其化合物都跟化学有关.
“化学--人类进步的关键”.化学在生产生活中有着广泛的运用,尤其是化学反应原理.人们平时所用的铁及其化合物都跟化学有关.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3FeO+10HNO3═3Fe(NO3)3+NO↑+5H2O | B. | C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O | ||
| C. | Al(OH)3+3HNO3═Al(NO3)3+3H2O | D. | 3Zn+8HNO3═3Zn(NO3)2+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 向试管中加入2ml溶液 | 实验现象 |
 | 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 60s:反应进一步加快且反应剧烈放热,液体几乎沸腾 120s:铝片反应完,试管中析出大量蓬松的红色物质 |
| 实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 60s:铝片表面有极少气泡 120s:有少量气泡溢出,铝片边缘有很少红色物质生成 |
| 实验 | 向试管中加入2mL溶液 | 实验现象 |
 | 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
| 实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
| 实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
| 实验Ⅵ:0.5mol/LCuSO4溶液+0.02mol NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某放热反应能自发进行,因此该反应是熵增反应 | |
| B. | 用惰性电极电解含有 H218O的普通水时,阳极可能产生两种相对分子质量不同的氧分子 | |
| C. | 反应 A(g)?B(g)△H,若正反应的活化能为 EakJ/mol,逆反应的活化能为 EbkJ/mol,则△H=-(Ea-Eb)kJ/mol | |
| D. | 3x%的 A 物质的溶液与 x%的 A 物质的溶液等体积混合后溶液质量分数小于 2x%,则 A 可 能为乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向0.10mol•L-1氨水中通SO2:c(NH4+)+c(NH3•H2O)═c(HSO3-)+c(SO32-)+c(H2SO3) | |
| B. | 向0.10mol•L-1KHSO3溶液中通NH3:c(K+)>c(SO32-)>c(NH4+) | |
| C. | 向0.10mol•L-1NH4HS溶液中通H2S:c(NH4+)═c(S2-)+c(HS-) | |
| D. | 向0.10mol•L-1Na2C2O4溶液中通HCl:c(Cl-)═c(HC2O4-)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl-、SO42-中的几种离子.
某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl-、SO42-中的几种离子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com