
【题目】主族元素X、Y、Z、W、R的原子序数依次增大,且它们的原子序数均不超过20。已知X原子最外层电子数是其最内层电子数的2倍,Y的最高正价与最低负价代数和为2,Z的周期数等于其族序数,W的最外层电子数与X的核外电子数相等,R的最外层电子数等于W和X的最外层电子数之差。下列说法正确的是
A.原子半径的大小顺序:r(W)>r(Z)>r(X)
B.最高价氧化物对应水化物的酸性:X>Y
C.常温下Z的单质与Y的最高价含氧酸浓溶液不发生反应
D.最高价氧化物对应水化物的碱性:Z<R
【答案】D
【解析】
主族元素X、Y、Z、W、R的原子序数依次增大,且它们的原子序数均不超过20。
已知X原子最外层电子数是其最内层电子数的2倍,说明电子排布为2、4即碳元素;
Y的最高正价与最低负价代数和为2,说明最高价+5,最低价-3,即为氮元素;
Z的周期数等于其族序数,即为第三周期第ⅢA族,即铝元素;
W的最外层电子数与X的核外电子数相等,电子排布为2、8、6即硫元素;
R的最外层电子数等于W和X的最外层电子数之差,电子排布为2、8、8、2即钙元素;

A选项,Al半径大于S,故A错误;
B选项,C最高价氧化物对应水化物是碳酸,N最高价氧化物对应水化物是硝酸,碳酸酸性比硝酸酸性弱,故B错误;
C选项,Al和浓硝酸发生钝化,是发生反应了的,故C错误;
D选项,氢氧化钙的碱性比氢氧化铝碱性强,氢氧化铝具有两性,故D正确;
综上所述,答案为D。


科目:高中化学 来源: 题型:
【题目】![]() 是重要的核工业原料。下列有关
是重要的核工业原料。下列有关![]() 、
、![]() 说法正确的是
说法正确的是
A. ![]() 原子核中含有92个中子 B.
原子核中含有92个中子 B. ![]() 原子核外有143个电子
原子核外有143个电子
C. ![]() 与
与![]() 互为同位素 D.
互为同位素 D. ![]() 与
与![]() 互为同素异形体
互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的CuO和MgO粉末分别溶于同体积的硝酸中,无固体剩余,得到的Cu(NO3)2和Mg(NO3)2的物质的量浓度分别为a molL﹣1和bmolL﹣1(假设反应前后溶液体积无明显变化),则a与b的关系为( )
A.a=bB.a=2bC.2a=bD.a=5b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煅烧硫酸亚铁反应为2FeSO4 ![]() SO2↑+SO3↑+Fe2O3,有关说法不正确的是
SO2↑+SO3↑+Fe2O3,有关说法不正确的是
A.该反应中FeSO4既作氧化剂又作还原剂
B.SO2能使酸性KMnO4溶液褪色,说明SO2具有还原性
C.该反应中每生成1 mol Fe2O3转移电子数为2×6.02×1023
D.将反应生成的气体通入BaCl2溶液中,无沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《 Journal of Energy Chemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是

A. a为负极
B. 熔盐可用KOH溶液代替
C. d极电极反应式为CO32-+4e-===C+3O2-
D. 转移lmol电子可捕获CO211.2L(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某样品中氟元素的质量分数进行如下实验,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(氢氟酸为低沸点酸,含量低,不考虑对玻璃仪器的腐蚀),用水蒸气蒸出,再通过滴定测量。实验装置如下图所示,加热装置省略。
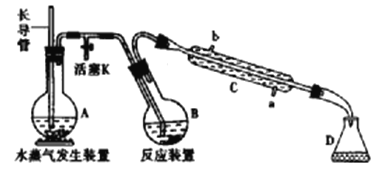
(1)A的名称是___________,长导管用于平衡压强,实验过程中其下端___________(填“能”或“不能”)在液面以上。
(2)仪器C是直形冷凝管,实验过程中,冷却水应从___________口出。(填“a”或“b")
(3)实验时,首先打开活塞K,待水沸腾时,关闭活塞K,开始蒸馏:若蒸馏时因反应装置局部堵塞造成长导管水位急剧上升,应立即______________________。
(4)连接水蒸气发生装置和反应装置之间的玻璃管常裹以石棉绳,其作用是___________。
(5)B中加入一定体积高氯酸和1.00g氟化稀土矿样,D中盛有滴加酚酞的NaOH溶液。加热A、B,使A中产生的水蒸气进入B。
①下列物质不可代替高氯酸的是___________(填标号)
a.醋酸 b.硝酸 c.磷酸 d.硫酸
②D中主要反应的离子方程式为_________________________________。
(6)向馏出液中加入25.00mL0.100mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用0.100 mol·L -1EDTA标准溶液滴定剩余La3+(La3+与EDTA按1︰1络合),消耗EDTA标准溶液20.00mL,则氟化稀土样品中氟的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是潜在的碳资源,无论是天然的二氧化碳气藏,还是各种炉气、尾气、副产气,进行分离回收和提浓,合理利用,意义重大。
(1)在空间站中常利用CO2(g)+2H2(g)![]() C(s)+2H2O(g),再电解水实现O2的循环利用,350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应。
C(s)+2H2O(g),再电解水实现O2的循环利用,350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应。
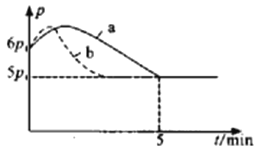
①若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强(p)随时间(t)的变化如图中a所示,则上述反应的△H___________0(填“>”或“<”);其他条件相同时,若仅改变某一条件,测得其压强(p)随时间(t)的变化如图中曲线b所示,则改变的条件是___________。
②图是反应平衡常数的对数与温度的变化关系图,m的值为___________。

(2)CO2在 Cu-ZnO催化下,同时发生如下反应I,II,是解决温室效应和能源短缺的重要手段。
Ⅰ.CO2(g)+3H2(g)![]() CH3OH (g)+H2O(g) △H1<0
CH3OH (g)+H2O(g) △H1<0
Ⅱ.CO2(g)+H2(g)![]() CO(g)+ H2O(g) △H2>0
CO(g)+ H2O(g) △H2>0
保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量及总压强如下表:

若反应I、II均达平衡时,p0=1.4p,则表中n=__________;反应1的平衡常数Kp=____ (kPa)-2。(用含p的式子表示)
(3)Al-CO2电池是一种以低温熔融盐[Al2(CO3)3]为电解质,以完全非碳的钯Pd包覆纳米多孔金属为催化剂正极的可充电电池。正极反应为:3CO2+4e-=2CO32-+C,则生成Al的反应发生在___________极(填“阳”或“阴”),该电池充电时反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氨肥样品可能含有NH4HCO3、NH4Cl、.NH4NO3中的一种或几种。称取该样品1.000克,溶于水配成100mL溶液,将溶液分成两等份依次完成如下实验:
①向一份溶液中加入10mL0.2 mol·L-1的盐酸与之充分反应,可收集到标准状况下的CO2气体44.8mL(设产生的CO2全部逸出)。
②向另一份溶液中加入足量的6mol·L-1氢氧化钠溶液,加热,产生的气体(设产生的NH3全部逸出)至少需要25mlL0.15 mol·L-1的硫酸才能被完全反应。下列说法正确的是
A. 1.000g样品中一定含有NH4HCO30.316克
B. 向①反应所得的溶液中加入硝酸酸化的硝酸银溶液,若有白色沉淀生成,说明原样品中一定含有NH4Cl
C. 原样品的含氨量为21%
D. 无需另外再设计实验验证,就能确定原样品中是否含有NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z
2Z
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 升高温度平衡常数增大,则此反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com