
规范书写是我们学习中必须遵循的原则,小明在元素周期表中查找到如图所示的一格后,明白了不能把一氧化碳写成“Co”的原因.
(1)“Co”表示 元素(填名称);
(2)“CO”是由 两种元素(填名称)组成的 (填“单质”或“化合物”).

考点:
元素的符号及其意义;单质和化合物的判别;化学式的书写及意义.
专题:
化学用语和质量守恒定律.
分析:
(1)根据元素在元素周期表中的说明示意图,可得的信息为:原子序数、相对原子质量、核内质子数、核外电子数、元素种类等.
(2)根据一氧化碳的化学式和元素组成回答.
解答:
解:(1)由图示可知“Co”表示 钴 元素;
(2)一氧化碳的化学式为CO,是由 碳和氧 两种元素组成,属于纯净物中的化合物.
故答案为:(1)钴;
(2)碳和氧;化合物.
点评:
本题考查了元素周期表中看图回答最简单的元素名称、符号、原子序数、相对原子质量,学生必须掌握单质及其化合物的概念及判断.


科目:高中化学 来源: 题型:
从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平.B是一种比水轻的油状液态烃,0.1mol该烃在足量的氧气中完全燃烧,生成0.6molCO2和0.3mol水;回答下列问题:
(1)A的电子式 ,B的结构简式 或.
(2)A和B中,能使溴的四氯化碳溶液褪色的化学反应方程式: ,反应类型:
(3)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式: ,
(4)等质量的A、B完全燃烧时消耗O2的物质的量 (填“A>B”、“A<B”或“A=B”).
(5)B与H2加成反应的产物的二氯代物的结构简式:、、、.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组微粒中,都互为等电子体的是( )
|
| A. | CO、NO、NaH、N2 | B. | SO2、NO2+、N3﹣、OCN﹣ |
|
| C. | CO32﹣、NO3﹣、BCl3 | D. | SiF4、SiO44﹣、SO32﹣、PO43﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是钠元素和氯元素在元素周期表中的信息和有关的4种粒子结构示意图.下列说法正确的是( )

|
| A. | 钠、氯都属于金属元素 |
|
| B. | 氯化钠是由a、d两种粒子构成的 |
|
| C. | 氯的相对原子质量是35.45g |
|
| D. | a表示的是一种阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
钒被誉为“合金中的维生素”,钒元素的部分信息如图.下列有关钒的说法正确的是( )
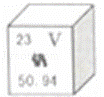
|
| A. | 属于非金属元素 | B. | 原子序数为23 |
|
| C. | 原子核外电子数为28 | D. | 相对原子质量为50.94g |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()
A. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=﹣4b kJ/mol
B. C2H2(g)+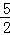 O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
C. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=2b kJ/mol
D. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
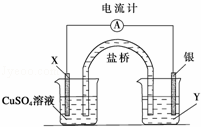
根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池:
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;
X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极(填具体电极如Ag”).
查看答案和解析>>
科目:高中化学 来源: 题型:
日常生活中使用的铝合金中的铝来自于电解氧化铝.工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为Si02、Fe2O3、Ca0、Mg0、Na20等.工业生产铝锭的工艺流程示意图如下:
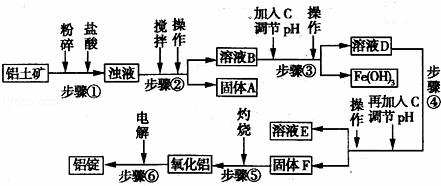
一些氢氧化物沉淀的pH如表:
沉淀物 Al(OH)3 Fe(OH)3 Mg(OH)2
开始沉淀pH(离子初始浓度为0.01mol/L) 4 2.3 10.4
完全沉淀pH(离子初始浓度为<10﹣5mol/L) 5.2 4.1 12.4
请回答下列问题:
(1)实验室进行步骤④的操作名称为 .
(2)固体A的化学式为 ,物质C的化学式为 .
(3)步骤④调节pH的范围为 .
(4)步骤⑥反应的化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com