
| A. | 可作食品调味剂 | B. | 可作食品防腐剂 | ||
| C. | 可作配制0.9%生理盐水的原料 | D. | 电解饱和食盐水可得到金属钠 |
分析 食盐常用于调味品,可使细胞脱水而起到防腐剂的作用,医疗上可作配制0.9%生理盐水的原料,工业常用于氯碱工业制备氯气、氢气和氢氧化钠,也常用于纯碱工业,电解熔融的食盐可得到金属钠,以此解答.
解答 解:A.钠元素为人体不可缺少的元素,食盐可用于食品调味剂,具有咸味,故A正确;
B.食盐可使细胞脱水而起到防腐剂的作用,故B正确;
C.人的上皮细胞生活的环境是0.9%的生理盐水,如果盐水的浓度过高或过低,都可能使细胞发生变形,滴加0.9%的生理盐水,以保持细胞的正常形态,故C正确;
D.钠性质活泼,与水剧烈反应,工业电解饱和食盐水2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,制备氯气、氢气和氢氧化钠,用食盐、氨气、二氧化碳制备纯碱,所以电解食盐水不能制得钠,应电解熔融氯化钠,2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,得到金属钠,故D错误.
故选D.
点评 本题考查氯化钠的性质与用途,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学元素,提高学习的积极性,难度不大,注意相关基础知识的积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
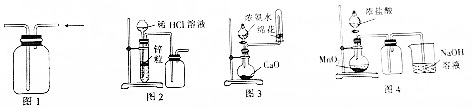
| A. | 用图1所示装置收集CO和NO | B. | 用图2所示装置制取少量氢气 | ||
| C. | 用图3所示装置制取少量氨气 | D. | 用图4所示装置制取少量氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
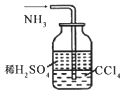 | 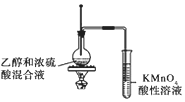 | 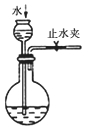 | 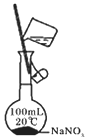 |
| ①收集NH3 | ②验证乙烯的生成 | ③检查装备的气密性 | ④配制一定物质的量浓度的NaNO3溶液 |
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同位素1H的相对原子质量 | |
| B. | 氢元素的平均相对原子质量 | |
| C. | 氢元素各同位素质量数与百分含量算出的平均值 | |
| D. | 同位素2H的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 怀化市医疗机构临床检验结果报告单 | ||||
| 分析项目 | 检测结果 | 单位 | 参考范围 | |
| 1 | 锌(Zn) | 115.92 | μmol/L | 66-120 |
| 2 | 铁(Fe) | 6.95↓ | mmol/L | 7.52-11.82 |
| 3 | 钙(Ca) | 1.68 | mmol/L | 1.55-2.10 |
| … | ||||
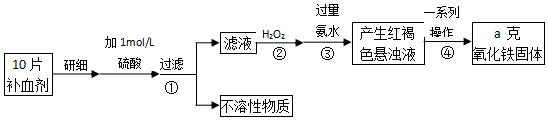
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH数据推测相同浓度的不同强酸弱碱盐在水溶液中水解程度的大小 | |
| B. | 用反应热数据的大小判断不同反应反应速率的快慢 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 用平衡常数的大小判断化学反应可能进行的程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
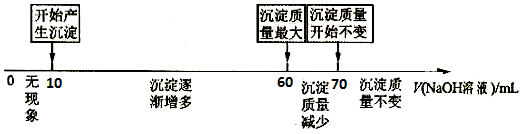
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500mL溶液中所含K+、SO42-总数为0.3NA | |
| B. | 500mL溶液中含有0.1NA个K+离子 | |
| C. | 1L溶液中K+离子浓度是0.2mol/L | |
| D. | 2L溶液中SO42-离子浓度是0.4mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com