
| A、氢氧化钠溶液和稀硝酸反应 |
| B、氨水和稀盐酸反应 |
| C、Ba(OH)2溶液滴入稀硫酸中 |
| D、二氧化碳通入澄清石灰水中 |


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
| A、pH=0的溶液:Fe3+、Ag(NH3)2+、NO3-、SO42- |
| B、滴加石蕊试液显蓝色的溶液:K+、Al3+、NO3-、F- |
| C、c(H+)<c(OH-)的溶液中:Na+、K+、SO32-、S2O32- |
| D、某酸性溶液:Ca2+、HCOO-、MnO4-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、间二甲苯和乙苯 |
| B、2-甲基2,4-己二烯和3,4-二甲基-1-戊炔 |
| C、2,2,3-三甲基戊烷和3-乙基己烷 |
| D、2-甲基丙烯酸和甲酸正丙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3-)>c(Cl-)>c(I-)>c(Ag+) |
| B、溶液中先产生的是AgI沉淀 |
| C、AgCl的KSP的数值为1.69×10-10 |
| D、若在AgI悬浊液中滴加一定量的KCl溶液,黄色沉淀会转变成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
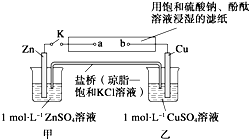 将图所示实验装置的K闭合,下列判断正确的是( )
将图所示实验装置的K闭合,下列判断正确的是( )| A、Cu是正极 |
| B、电子沿 Zn→a→b→Cu 路径流动 |
| C、盐桥中Cl-移向CuSO4溶液 |
| D、片刻后可观察到滤纸a点变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业用石英砂制取含28 g硅单质的粗硅,转移电子数为4NA |
| B、1 L 1 mol?L-1 MgCl2溶液含有NA个Mg2+ |
| C、醋酸的摩尔质量与NA个醋酸分子的质量在数值上相等 |
| D、25℃,1.01×l05 Pa时,16 g臭氧所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水中滴加NaOH溶液后,黄绿色褪去Cl2+2OH-=Cl-+ClO-+H2O |
| B、向NaHCO3溶液中滴加酚酞溶液,溶液变红HCO3-?H++CO32- |
| C、向Al2(SO4)3溶液中滴加过量氨水,生成白色沉淀Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
D、向少量苯酚钠溶液中通入少量CO2,溶液变浑浊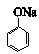 +CO2+H2O→ +CO2+H2O→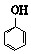 +NaHCO3 +NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 200 | 300 | 400 | 500 |
| K | K1 | K2 | 0.5 | K3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com