
某同学设计如下实验验证炭与浓硫酸的反应产物及产物的某些性质。

(1)装置A中盛放浓硫酸的仪器名称是 。
(2)若要证明有水生成,需要在A、B之间加装盛有 的干燥管。
(3)利用装置B可以完成的实验是 。
(4)若在E中盛装澄清石灰水,C中盛装酸性高锰酸钾溶液,则D中的试剂是 ,其作用是 ;写出C中关于高锰酸钾发生反应的离子方程式 。
(1)分液漏斗,
(2)无水硫酸铜(变色硅胶)
(3)探究SO2与品红反应的可逆性(写“加热可以使品红恢复红色”或相近意思也可)
(4)品红溶液(酸性高锰酸钾溶液),确认(检验)二氧化硫已经除尽,
2MnO4—+5SO2+2H2O=2Mn2++5SO42—+4H+(若配平错误,反应式正确给1分)
【解析】
试题分析:(1)盛浓硫酸的仪器为分液漏斗。(2)无水硫酸铜遇到水会变蓝,所以通常使用无水硫酸铜检验水。(3)B中盛放的是品红,遇到二氧化硫红色褪去,加热后红色可以恢复,所以可以探究SO2与品红反应的可逆性。(4)因为二氧化硫也能使澄清的石灰水变浑浊,干扰二氧化碳的检验,所以需要用高锰酸钾除去二氧化硫,然后用品红溶液或酸性高锰酸钾溶液确认二氧化硫已经除尽。C中二氧化硫被高锰酸钾氧化成硫酸根离子,锰元素还原为锰离子,离子方程式为:2MnO4—+5SO2+2H2O=2Mn2++5SO42—+4H+。
考点:浓硫酸的性质,二氧化硫的性质。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源:2014-2015学年甘肃省天水市高三一轮复习基础知识检测化学试卷(解析版) 题型:填空题
(12分)按要求完成下列各小题。

(1)甲中显酸性的官能团是 (填名称)。
(2)下列关于乙的说法正确的是 (填序号)。
a.分子中碳原子与氮原子的个数比是7 : 5
b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应
d.属于苯酚的同系物
(3)写出丙物质与足量NaOH溶液共热的化学方程式 。
(4)已知以下信息:


1molB经上述反应可生成2molC,且C不能发生银镜反应。
则由A生成B的化学方程式为
(5) 的一种同分异构体满足下列条件:
的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式: 。
(6)已知有下列反应:
试写出只用1,3-丁二烯合成六元环化合物的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一上学期期中化学试卷(解析版) 题型:填空题
(8分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子:K+ Na+ Cu2+ Al3+
阴离子:SO42- HCO3- OH- Cl-
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成。根据上述实验填空:
(1)写出B、D的化学式:B ____,D 。
(2)C可用作净水剂,用离子方程式表示其净水原理____ ___。
(3)将含0.01 mol A的溶液与含0.02 mol E的溶液反应后,向溶液中滴加0.1 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是


(4)在m mL b mol·L-1 C溶液中,加入等体积a mol·L-1 的E溶液。
当a≤3b时,生成沉淀的物质的量是 mol;
当3b<a<4b件时,生成沉淀的物质的量是 mol。
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一上学期期中化学试卷(解析版) 题型:选择题
下列各组离子中,在强碱性溶液中能共存,且在加入盐酸过程中会产生气体和沉淀的是
A. Na+、NO3-、AlO2-、SO42- B. Na+、Al3+、NO3-、SO42-
C. Na+、Mg2+、Cl-、HCO3- D. K+、Cl-、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一上学期期中化学试卷(解析版) 题型:选择题
向100ml的下列各溶液中加入少量的NaOH固体,溶液导电性变化最不明显的是
A.盐酸 B.醋酸 C.蒸馏水 D.氨水
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省吉林市高一上学期期末考试化学试卷(解析版) 题型:选择题
设阿伏加德罗常数(NA)的数值为nA,下列说法中正确的是
A.1 mol Cl2与足量NaOH反应,转移的电子数为2nA
B.1 mo1Na被完全氧化生成Na2O2,失去的电子数为2nA
C.常温常压下,22.4LSO2气体中含有的原子数小于3nA
D.0.1 mol/LNaOH溶液中含有Na+的数目为0. 1 nA
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省吉林市高一上学期期末考试化学试卷(解析版) 题型:选择题
为了检验某固体物质中是否含有NH4+,下列组合正确的是
①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸
A.①③ B.④⑤ C.①②③ D.①④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省长沙市望城区高一上学期期末化学试卷(解析版) 题型:填空题
(6分)在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O的反应中, 是氧化剂,氧化产物是 ,此反应中,HCl表现的性质有酸性和______性。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三上学期期末考试化学试卷(解析版) 题型:填空题
(17分)二甲醚是一种重要的清洁燃料。合成二甲醚是解决能源危机的研究方向之一。
(1)用CO2和H2可以合成二甲醚(CH3OCH3)

(2)已知在一定温度下,以下三个反应的平衡常数为k1、k2、k3:
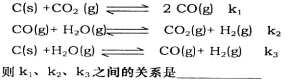
(3)二甲醚(CH3OCH3)燃料电池可以提升能量利用率。利用二甲醚酸性介质燃料电池电解100mL 1mo1 的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的负极反应式为_____________。
②电解后溶液的PH=_________________________
(4)工业合成氨的反应为: mol-1
mol-1
已知合成氨反应在某温度下2L的密闭绝热容器中进行,测得数据如下表:

根据表中数据计算:
①0 min~1 min内N2的平均反应速率为_________
②该条件下反应的平衡常数k=________(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向_______(填“正向”、“逆向”或“不移动”),该反应的平衡常数k___________(填“变大”“减小”或“不变”)
(5)常温下,将0.2mol HCOOH和0.1mol
HCOOH和0.1mol NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。该溶液中[HCOOH]-[OH-]+[H+]=______mol
NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。该溶液中[HCOOH]-[OH-]+[H+]=______mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com