
| ���� | CaCO3 | MgCO3 | Ca��OH��2 | Mg��OH��2 |
| �ܶȻ� | 2.8��10-9 | 6.8��10-6 | 5.5��10-6 | 1.8��10-11 |
| ||
| ||
| Ksp[Mg(OH)2] |
| c(Mg2+) |
|
| 2 |
| 8.000��10-4mol |
| 5 |
| n(Ca2+) |
| 0.08000g |
| 0.2000g |


 ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ƽ����ϵ�м�������KCl���壬��Һ��ɫ��dz |
| B����������FeCl3���壬��Һ��ɫ���� |
| C������ϵ��ѹ����Һ��ɫû�����Ա仯 |
| D��Fe��SCN��3�������࣬��һ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 A��B��C��D��E��Ϊ��ѧ��ѧ���������ʣ����Ǽ�ķ�Ӧ��ϵ����ͼ��ʾ��
A��B��C��D��E��Ϊ��ѧ��ѧ���������ʣ����Ǽ�ķ�Ӧ��ϵ����ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼ��A��G�ǻ����H��һ����ɫ��̬���ʣ�D�����������壬����������һ����ɫҺ�壬EΪ����ɫ�Ĺ��壮����֮��������ת����ϵ��
��ͼ��A��G�ǻ����H��һ����ɫ��̬���ʣ�D�����������壬����������һ����ɫҺ�壬EΪ����ɫ�Ĺ��壮����֮��������ת����ϵ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ��Cl2��ζ |
B�� ��ȥCl2�е�HCl |
C��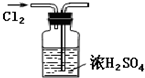 ����Cl2 |
D�� �ø�����غ�Ũ���������ȡCl2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com