
甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
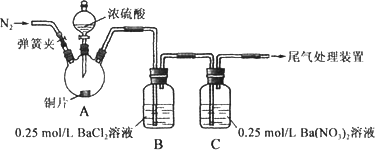
实验操作和现象:

(1)A中反应的化学方程式是________.
(2)C中白色沉淀是________,该沉淀的生成表明SO2具有________性.
(3)C中液面上方生成浅棕色气体的化学方程式是________.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上: 甲在原有操作之前增加一步操作,该操作是________;乙在A、B间增加洗气瓶D,D中盛放的试剂是________.
②进行实验,B中现象:
![]()
检验白色沉淀,发现均不溶于稀盐酸.结合离子方程式解释实验现象异同的原因:________.
(5)合并(4)中两同学的方案进行试验.B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是________.
科目:高中化学 来源: 题型:
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |

查看答案和解析>>
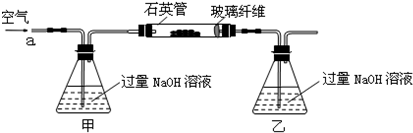
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
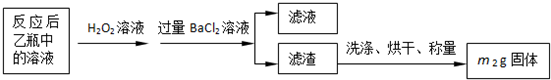
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
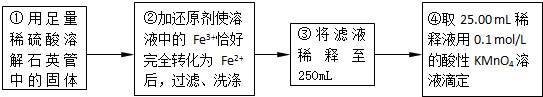
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 24.97 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2Fe2O3+8SO2
2Fe2O3+8SO2  2Fe2O3+4SO2
2Fe2O3+4SO2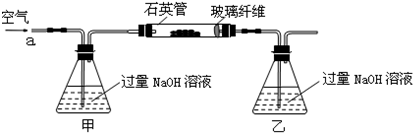
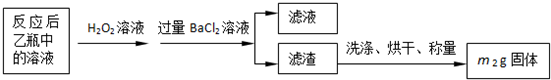
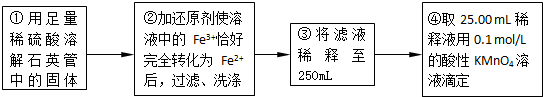
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 24.97 |
查看答案和解析>>
科目:高中化学 来源:东城区二模 题型:问答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
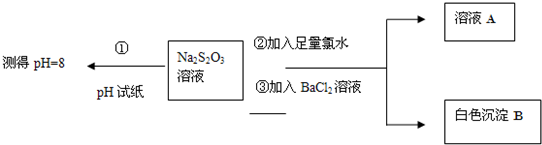
查看答案和解析>>
科目:高中化学 来源:2011年北京市东城区高考化学二模试卷(解析版) 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
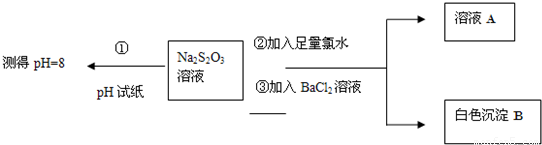
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com