
分析 (1)硝酸银和氯化钠反应生成氯化银和硝酸钠;
(2)二氧化碳与澄清石灰水反应生成碳酸钙沉淀和水;
(3)Fe2(SO4)3是强电解质,能完全电离为铁离子和硫酸根离子;
(4)H++OH-=H2O对应的化学方程式可以是强酸和强碱反应生成可溶性盐和水;
(5)CO32-+2H+=CO2↑+H2O对应的化学方程式是可溶性碳酸盐和强酸反应生成可溶性盐酸盐和二氧化碳和水.
解答 解:(1)硝酸银和氯化钠反应生成氯化银和硝酸钠,离子反应为Cl-+Ag+═AgCl↓,故答案为:Cl-+Ag+═AgCl↓;
(2)二氧化碳与澄清石灰水反应生成碳酸钙沉淀和水:CO2+Ca(OH)2═CaCO3↓+H2O,其中氢氧化钙可以拆,故离子方程式为:CO2+Ca2++2OH-═CaCO3↓+H2O
,故答案为:CO2+Ca2++2OH-═CaCO3↓+H2O;
(3)Fe2(SO4)3是强电解质,能完全电离为铁离子和硫酸根离子,故用等号,故电离方程式为:Fe2(SO4)3=2Fe3++3SO42-,
故答案为:Fe2(SO4)3=2Fe3++3SO42-;
(4)H++OH-=H2O对应的化学方程式可以是强酸和强碱反应生成可溶性盐和水,故对应的化学方程式可以是:HCl+NaOH=NaCl+H2O,
故答案为:HCl+NaOH=NaCl+H2O;
(5)CO32-+2H+=CO2↑+H2O对应的化学方程式必须是可溶性碳酸盐和强酸反应生成可溶性盐酸盐和二氧化碳和水,故对应的化学方程式可以是Na2CO3+2HCl=2NaCl+H2O+CO2↑,故答案为:Na2CO3+2HCl=2NaCl+H2O+CO2↑.
点评 本题考查了离子方程式的书写、电离方程式的书写和根据离子方程式来改写为化学方程式,难度不大,应注意的是凡是离子形式出现的,说明该离子所对应的物质是能拆的.


科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/(mol•L-1) | 0.1 | 0.2 | 0 |
| 2min末浓度/(mol•L-1) | 0.08 | a | b |
| 平衡浓度/(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 平衡时,X的转化率为20% | |
| B. | 2min时Y的物质的量为0.14 | |
| C. | 增大平衡后的体系压强,v(正)增大,v(逆)减小 | |
| D. | 2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)═H2(g)+O2(g)△H=+242 kJ•mol-1 | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | ||
| C. | H2(g)+O2(g)═H2O(g)△H=+242 kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
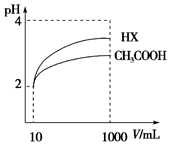 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选 项 | 操 作 | 现 象 | 结 论 |
| A | 向无水乙醇中滴入酸性KMnO4溶液,充分振荡 | 紫红色褪去 | 乙醇有氧化性 |
| B | 向某溶液中滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中一定有SO42- |
| C | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可用于自来水消毒 | |
| B. | 40%的甲醛水溶液可用作防腐剂,浸制生物标本 | |
| C. | 工业酒精可用于酿造饮用酒 | |
| D. | 食盐中添加碘酸钾(KIO3)加工碘盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com