
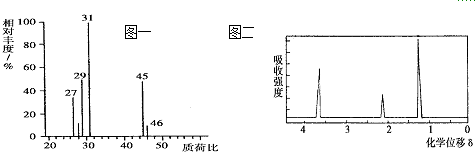
分析 (1)根据质荷比可知,有机物A的相对分子质量;
(2)根据n=$\frac{m}{M}$计算生成的水的物质的量,计算碳元素、氢元素的质量,根据质量守恒判断有机物A是否含有氧元素,若含有氧元素,计算氧元素质量、氧原子物质的量,根据原子守恒确定有机物A中C、H、O原子个数比值确定最简式,再由核磁共振氢谱可知,该有机物分子中有3中化学环境不同的H原子,三种H原子数目之比为1:2:3,结合有机物的分子式确定其可能的结构;
(3)醇的同分异构包括同类异构和不同类异构,而同类异构可以视为醇羟基的取代,而不同类可以视为醚键插在碳碳键之间;
(4)首选CH3CH2OH在浓硫酸,170℃作用下发生消去反应,得到的乙烯与氯气发生加成反应即可.
解答 解:(1)在A的质谱图中,最大质荷比为46,所以其相对分子质量也是46,故答案为:46;
(2)将4.6 g该有机物完全燃烧,生成0.2mol CO2和5.4g水,则2.3g该有机物完全燃烧,生成0.1mol CO2和2.7g H2O,2.3 g该有机物中,n(C)=n(CO2)=0.1 mol,含有的碳原子的质量为m(C)=0.1 mol×12 g•mol-1=1.2 g,氢原子的物质的量为:n(H)=$\frac{2.7g}{18g/mol}$×2=0.3 mol,氢原子的质量为m(H)=0.3 mol×1 g•mol-1=0.3 g,该有机物中m(O)=2.3 g-1.2 g-0.3 g=0.8 g,氧元素的物质的量为n(O)=$\frac{0.8g}{16g/mol}$=0.05 mol,则n(C):n(H):n(O)=0.1 mol:0.3 mol:0.05 mol=2:6:1,所以A的实验式是C2H6O,2 个碳原子6个氢达饱和反应分子式为:C2H6O,由核磁共振氢谱可知,该有机物分子中有3中化学环境不同的H原子,三种H原子数目之比为1:2:3,故该有机物结构式为CH3CH2OH,
故答案为:CH3CH2OH;
(3)CH3CH2OH无同类同分异构,只有不同类异构醚,即甲醚,结构简式为:CH3OCH3,故答案为:CH3OCH3;
(4)首选CH3CH2OH在浓硫酸,170℃作用下发生消去反应,得到的乙烯与氯气发生加成反应,所以反应方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,CH2=CH2+Cl2→CH2ClCH2Cl,故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,CH2=CH2+Cl2→CH2ClCH2Cl.
点评 本题考查有机物分子式与结构确定、同分异构体的书写等,难度中等,注意燃烧法利用原子守恒确定有机物的分子式,侧重对基础知识与学生综合能力考查,注意对有机谱图的简单认识.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,黄绿色固体:
,黄绿色固体: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
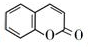
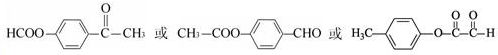
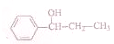 的化学方程式(无机试剂任选)
的化学方程式(无机试剂任选)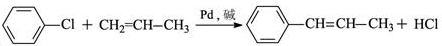 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
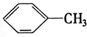 ②
②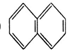 ③
③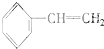 ④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦
④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦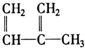 ⑧
⑧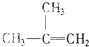
| A. | ⑦和⑧ | B. | ⑤和⑦ | C. | ①、②和③ | D. | ④、⑥和⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正戊烷分子中的最多有5个原子在同一平面上 | |
| B. | 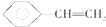 分子中最多有8个原子在同一平面上 分子中最多有8个原子在同一平面上 | |
| C. | CH2=CH-CH=CH2所有原子可能在同一直线上 | |
| D. | 2-丁烯(CH3CH=CHCH3)分子中4个碳原子可能在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y |
| A | Al | NaOH溶液 |
| B | NO2 | H2O |
| C | Na2O2 | CO2 |
| D | Fe | H2O(g) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
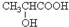 .
. .
.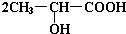 +Na2CO3→
+Na2CO3→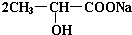 +H2O+CO2↑.
+H2O+CO2↑.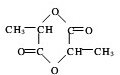 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com