
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_________________________。
(2)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。
在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为__________________
,其离子方程式为__________________
【答案】2NH3+2O2 N2O+3H2O 3HClO+2NO+H2O=3Cl+2
N2O+3H2O 3HClO+2NO+H2O=3Cl+2![]() +5H+
+5H+
【解析】
(1)NH3与O2在加热和催化剂作用下发生氧化还原反应生成N2O和H2O。
(2)在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO3-,根据氧化还原反应原理书写离子方程式。
(1)NH3与O2在加热和催化剂作用下生成N2O和H2O,其化学方程式为2NH3+2O2 N2O+3H2O;故答案为:2NH3+2O2
N2O+3H2O;故答案为:2NH3+2O2 N2O+3H2O。
N2O+3H2O。
(2)在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO3-,根据氧化还原反应原理写出离子方程式,其离子方程式为3HClO+2NO+H2O=3Cl-+2 NO3-+5H+;故答案为:3HClO+ 2NO + H2O=3Cl-+2 NO3-+5H+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
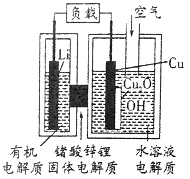
A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,负极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制钛白粉产生的废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可利用酸解法生产补血剂乳酸亚铁。其生产流程如下:

已知:TiOSO4可溶于水,在水中电离为TiO2+和SO42-。请回答下列问题:
(1)写出TiOSO4水解生成钛酸H4TiO4的离子方程式__________________________。步骤①中加入足量铁屑的目的是______________。
(2)工业上由H4TiO4可制得钛白粉TiO2。TiO2直接电解还原法(剑桥法)生产钛 是一种较先进的方法,电解质为熔融的CaCl2,原理如图所示,阴极的电极反应为_______________。
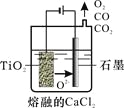
(3)步骤②的离子方程式是____________________________,所得副产品主要 是__________(填化学式)。
(4)步骤④的结晶过程中必须控制一定的真空度,原因是_____________________。
(5)乳酸可由乙烯经下列步骤合成:
![]()
上述合成路线的总产率为60%,乳酸与碳酸亚铁反应转化为乳酸亚铁晶体的产率为90%,则生产468 kg乳酸亚铁晶体(M=234 g/mol)需要标准状况下的乙烯________m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3,混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是

A. a点对应的溶液中:Na+、OH-、SO42-、NO3-
B. b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中:F-、NO3-、Fe2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯为原料合成F,转化关系如下:
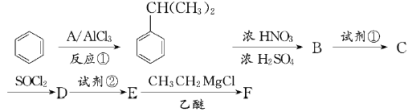
F是一种具有重要工业价值的芳香化合物,含有C、H、O、N四种元素,其蒸气密度是相同状况下氢气密度的74.5倍,分子中有两个互为对位的取代基。C能与碳酸氢钠溶液反应,试剂②为Fe/HCl。
已知:① ;
;
②![]() (苯胺:弱碱性,易被氧化)
(苯胺:弱碱性,易被氧化)
③RCOCl![]() RCOR’
RCOR’
请回答下列问题:
(1)反应①为加成反应,写出A的化学式:_____________。
(2)B中所含官能团的名称为________;生成B时,常伴有副反应发生,反应所得产物除B外可能还含有____________________(写出一种产物的结构简式)。
(3)试剂①是_____________;试剂①和试剂②的顺序能否互换:________(填“能”或“不能”);为什么?_________________________________________________________。
(4)E生成F的化学方程式为__________________________________________________。
(5)参照上述合成路线,以(CH3)2CHCHO和CH3MgCl为原料(无机试剂任选),设计制备(CH3)2CHCOCH3的合成路线____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )
A.3 mol·L-1B.2 mol·L-1C.4 mol·L-1D.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
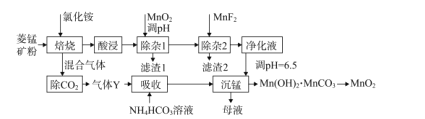
【题目】利用菱锰矿(主要成分是MnCO3,含少量A12O3、Fe2O3、FeO、CaO、MgO等)为原料制备MnO2的工艺流程如下:
已知:①25℃时,![]()
②相关金属离子![]() 形成氢氧化物沉淀pH范围如下:
形成氢氧化物沉淀pH范围如下:
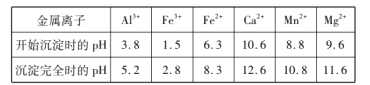
(1)“除杂1”中加入适量MnO2的作用是____,应调节溶液pH不小于____。
(2)“除杂2”的主要目的将Ca2+、Mg2+转化为相应的氟化物沉淀而除去,除去Ca2+的离子方程式为____,该反应的平衡常数为____。
(3)“沉锰”中生成Mn(OH)2'MnCO3沉淀的离子方程式为____,“母液”经加热等系列操作后可返回“____”工序循环使用。
(4)以MnSO4-(NH4)2SO4为电解质溶液,利用下图装置可同时制备金属锰和MnO2。离子交换膜a为____,阳极电极反应式为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,以NH3作氢源,可实现电化学氢化反应。下列说法错误的是
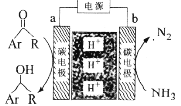
A.a为阴极
B.b电极反应为:2NH3-6e-=N2+6H+
C.电解一段时间后,装置内H+数目增多
D.理论上每消耗1 mol NH3,可生成1.5mol![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com