
| A. | 向溶解有Na2O2的水溶液中滴入2滴酚酞试液,溶液先变红振荡后褪色 | |
| B. | 氯气的性质活泼,它与氢气混合后立即发生爆炸 | |
| C. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到黑色Fe3O4 | |
| D. | 新制的氯水加入有色布条褪色,说明溶液中有Cl2存在 |
分析 A.过氧化钠与水反应生成NaOH,具有碱性,且过氧化钠具有强氧化性;
B.氯气与氢气常温下不反应;
C.铁在纯氧中燃烧只生成四氧化三铁,Fe在高温下和水蒸气反应生成四氧化三铁和氢气;
D.氯水中含HClO,具有漂白性.
解答 解:A.过氧化钠与水反应生成NaOH,具有碱性,且过氧化钠具有强氧化性,则滴入2滴酚酞试液,溶液先变红振荡后褪色,故A正确;
B.氯气与氢气常温下不反应,光照、加热下反应,则常温下二者混合不发生爆炸,故B错误;
C.铁在纯氧中燃烧只生成四氧化三铁,Fe在高温下和水蒸气反应生成四氧化三铁和氢气,则均能得到黑色Fe3O4,故C正确;
D.氯水中含HClO,具有漂白性,则有色布条褪色,说明溶液中有HClO存在,不能说明溶液中有Cl2存在,故D错误;
故选BD.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及实验现象为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Na+、NO${\;}_{3}^{-}$、OH- | B. | NH${\;}_{4}^{+}$、Fe3+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | ||
| C. | SO${\;}_{4}^{2-}$、Cl-、Ba2+、Mg2+ | D. | H+、K+、CO${\;}_{3}^{2-}$、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
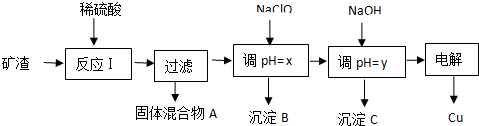
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “可燃冰”释放的甲烷属于烃 | |
| B. | “可燃冰”的分解与释放,可能会诱发海底地质灾害,加重温室效应 | |
| C. | “可燃冰”将成为人类的后续能源 | |
| D. | “可燃冰”是水变的油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片插入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag | |
| B. | 硫酸和氢氧化铜溶液混合:H++OH-═H2O | |
| C. | 石灰石中加入稀盐酸:CO32-+2H+═CO2↑+H2O | |
| D. | 硫酸和氢氧化钡溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸的电离方程式:H2SO3?2H++SO32- | |
| B. | 乙炔的分子结构模型示意图: | |
| C. | H2O2的电子式: | |
| D. |  互为同系物 互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com