
 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
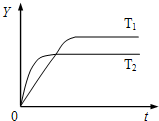 已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某体积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应.如图是某物理量(Y)随时间(t)变化的示意图,Y可以是( )
已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某体积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应.如图是某物理量(Y)随时间(t)变化的示意图,Y可以是( )查看答案和解析>>
科目:高中化学 来源:2013届江苏省泰州中学高三上学期期中考试化学试卷(带解析) 题型:实验题
(12分)尖晶石型锰酸锂(LiMn2O4)是一种环保绿色能源新型材料。实验室通过下列方法制取:将MnO2和Li2CO3按4︰1的物质的量比配料,球磨3~5小时,然后升温至600℃~750℃,保温24小时,自然冷却至室温得产品。
(1)保温24小时的目的是____________________________________________________。
(2)写出该反应的化学方程式_________________________________________________。
(3)实验室测定锰酸锂中锰的平均化合价的实验步骤如下:
步骤1:准确称取0.1g左右的尖晶石型锰酸锂试样于锥形瓶中,加入5mL稀硫酸、10.00mL 0.2000mol/L草酸钠(Na2C2O4)标准溶液,于80℃水浴加热溶解;
步骤2:待试样全部溶解,立即用浓度为0.2000mol/L的高锰酸钾溶液滴定至终点;
步骤3:计算样品得电子的物质的量n;
步骤4:将溶液中Mn2+氧化为Mn3+,再用硫酸亚铁铵标准溶液滴定,记录实验数据,计算出样品中Mn元素的质量为m;
步骤5:将实验步骤1-4重复2次。
已知反应: 2Mn3++C2O42-=2Mn2++2CO2↑;Mn4++C2O42-=Mn2++2CO2↑
2MnO4-+5C2O42-+16H+="2" Mn2++10 CO2↑+8H2O
①步骤2中,为判断滴定终点,_________(填“需要”或“不需要”)加入指示剂。
②步骤4中,滴定时盛放硫酸亚铁铵标准溶液的玻璃仪器是___________________。
③请用样品得电子的物质的量n和样品中Mn元素的质量m来表示样品中Mn元素的化合价=_____。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省高三上学期期中考试化学试卷(解析版) 题型:实验题
(12分)尖晶石型锰酸锂(LiMn2O4)是一种环保绿色能源新型材料。实验室通过下列方法制取:将MnO2和Li2CO3按4︰1的物质的量比配料,球磨3~5小时,然后升温至600℃~750℃,保温24小时,自然冷却至室温得产品。
(1)保温24小时的目的是____________________________________________________。
(2)写出该反应的化学方程式_________________________________________________。
(3)实验室测定锰酸锂中锰的平均化合价的实验步骤如下:
步骤1:准确称取0.1g左右的尖晶石型锰酸锂试样于锥形瓶中,加入5mL稀硫酸、10.00mL 0.2000mol/L草酸钠(Na2C2O4)标准溶液,于80℃水浴加热溶解;
步骤2: 待试样全部溶解,立即用浓度为0.2000mol/L的高锰酸钾溶液滴定至终点;
步骤3: 计算样品得电子的物质的量n;
步骤4:将溶液中Mn2+氧化为Mn3+,再用硫酸亚铁铵标准溶液滴定,记录实验数据,计算出样品中Mn元素的质量为m;
步骤5:将实验步骤1-4重复2次。
已知反应: 2Mn3++C2O42-=2Mn2++2CO2↑;Mn4++C2O42-=Mn2++2CO2↑
2MnO4-+5C2O42-+16H+=2 Mn2++10 CO2↑+8H2O
①步骤2中,为判断滴定终点,_________(填“需要”或“不需要”)加入指示剂。
②步骤4中,滴定时盛放硫酸亚铁铵标准溶液的玻璃仪器是___________________。
③请用样品得电子的物质的量n和样品中Mn元素的质量m来表示样品中Mn元素的化合价=_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com