
|
下列实验的操作方法正确的是 | |
A. |
在试管中加入2 mL 10%的CuSO4溶液,然后加入4~6滴10%的NaOH溶液振荡,再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基 |
B. |
用稀氨水清洗做过银镜反应的试管 |
C. |
用酸性高锰酸钾溶液区别直馏汽油和裂化汽油 |
D. |
用热NaOH溶液清洗盛过油脂的试管 |
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
 C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.| A | B | C | D | |
| Ⅰ | 0.05mol?L-1 | a mol?L-1 | 0.05mol?L-1 | b mol |
| Ⅱ | 0.078mol?L-1 | 0.078mol?L-1 | 0.122mol?L-1 | m mol |
| Ⅲ | 0.06mol?L-1 | 0.06mol?L-1 | 0.04mol?L-1 | n mol |
| Ⅳ | 0.07mol?L-1 | 0.07mol?L-1 | 0.098mol?L-1 | p mol |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
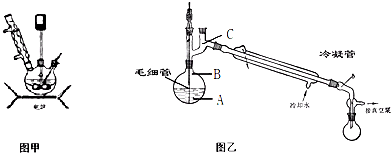
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g?cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
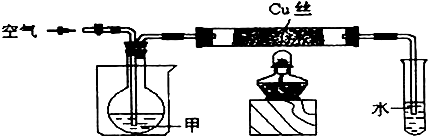
| △ |
| △ |
| 250-350℃ |
| Cu |
| 250-350℃ |
| Cu |
| 操作方法及所用试剂 | 实验现象 |
洗气、水 洗气、水 |
酸性高锰酸钾溶液褪色 酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
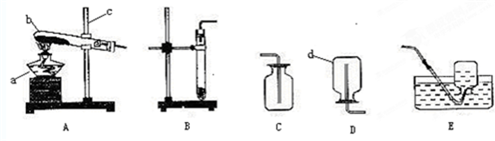
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com