
据报道,在300 ℃、70 MPa 条件下,由CO2和H2合成乙醇已成为现实,该合成对解决能源问题具有重大意义。
(1)已知25 ℃、101 kPa条件下,1 g乙醇燃烧生成CO2和液态水时释放出a kJ能量,请写出该条件下乙醇燃烧的热化学反应方程式: 。
(2)由CO2和H2合成乙醇的化学方程式为2CO2(g)+6H2(g)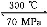 CH3CH2OH(g)+3H2O(g)。实验测得温度对反应的影响如图所示。
CH3CH2OH(g)+3H2O(g)。实验测得温度对反应的影响如图所示。
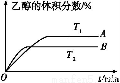
①正反应的ΔH 0(填“>”、“<”或“=”);
②该反应的化学平衡常数表达式为K= 。
(3)对于该化学平衡,为了提高H2的转化率,可采取的措施有 。
A.升温 B.加压
C.加催化剂D.增加CO2的浓度
(4)现有甲、乙两装置,甲装置为原电池,乙装置为电解池。
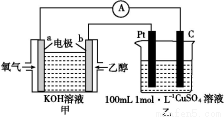
①b电极上发生的电极反应式为 。
②若甲中有0.1 mol CH3CH2OH参加反应,则乙装置中生成的气体在标准状况下的体积共为 L。
(1)C2H5OH(l)+3O2(g) 2CO2(g)+3H2O(l) ΔH=-46a kJ·mol-1
2CO2(g)+3H2O(l) ΔH=-46a kJ·mol-1
(2)①< ②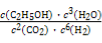 (3)BD
(3)BD
(4)①C2H5OH+16OH--12e-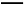 2C
2C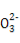 +11H2O
+11H2O
②17.92
【解析】(1)1 g乙醇燃烧放出a kJ热量,所以1 mol乙醇燃烧放出的热量为46a kJ。注意放热反应的ΔH<0。
(2)①T2时达到平衡所用时间短,说明温度高。但达到平衡时乙醇的体积分数小,说明升高温度平衡逆向移动,故ΔH<0。②根据平衡常数的定义即可写出平衡常数表达式。
(3)升温平衡逆向移动,H2的转化率减小,A错误;加压平衡正向移动,H2的转化率增大,B正确;催化剂不能使平衡移动,C错误;增加二氧化碳的浓度,平衡正向移动,H2的转化率增大,D正确。
(4)①该燃料电池的总反应为C2H5OH+3O2+4OH-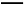 2C
2C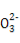 +5H2O,a极的电极反应式为O2+2H2O+4e-
+5H2O,a极的电极反应式为O2+2H2O+4e-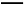 4OH-。用总反应式减去a极的电极反应式得b极的电极反应式为C2H5OH+16OH--12e-
4OH-。用总反应式减去a极的电极反应式得b极的电极反应式为C2H5OH+16OH--12e-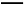 2C
2C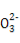 +11H2O。
+11H2O。
②若甲装置中有0.1 mol C2H5OH参加反应,则转移电子1.2 mol。乙装置中阳极的电极反应式为4OH--4e-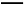 2H2O+O2↑,根据电子守恒可知该极生成0.3 mol O2。阴极先发生反应:2Cu2++4e-
2H2O+O2↑,根据电子守恒可知该极生成0.3 mol O2。阴极先发生反应:2Cu2++4e-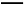 2Cu,因0.1 mol Cu2+消耗0.2 mol电子,故继续发生反应:2H++2e-
2Cu,因0.1 mol Cu2+消耗0.2 mol电子,故继续发生反应:2H++2e-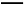 H2↑,转移1.0 mol电子生成0.5 mol H2。共生成0.8 mol气体,标准状况下其体积为17.92 L。
H2↑,转移1.0 mol电子生成0.5 mol H2。共生成0.8 mol气体,标准状况下其体积为17.92 L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考化学名师选择题专练 化学反应中的能量变化练习卷(解析版) 题型:选择题
已知:H2(g)+ O2(g)
O2(g)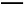 H2O(l)ΔH=-285.8 kJ/mol
H2O(l)ΔH=-285.8 kJ/mol
CH4(g)+2O2(g)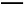 CO2(g)+2H2O(l)ΔH=-890.3 kJ/mol
CO2(g)+2H2O(l)ΔH=-890.3 kJ/mol
现有H2和CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3 242.5 kJ,则原混合气体中H2和CH4的物质的量之比是( )
A.1∶1 B.1∶3 C.1∶4 D.2∶3
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 NA的应用练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.5 mol/L MgCl2溶液中Cl-的数目为NA
B.58 g乙烯和乙烷的混合气体中碳原子数目一定为4NA
C.常温常压下,22.4 L NO和N2的混合气体中分子数目大于NA
D.标准状况下,0.5 mol氦气含有的电子数为NA
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 有机合成与推断练习卷(解析版) 题型:填空题
兔耳草醛是食品与化妆品工业中的香料添加剂。工业上可通过有机化工原料A制得,其合成路线如下图所示:
A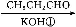 B
B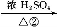 C
C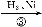 D
D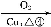
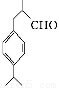 (兔耳草醛)
(兔耳草醛)
已知:①CH3CHO+CH3CHO CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO
②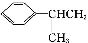 可写成
可写成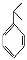
(1)B中含氧官能团的名称是 。
(2)上述合成路线中反应①属于 ,反应②属于 (填写反应类型)。
(3)写出由D获得兔耳草醛的化学反应方程式: 。
(4)A的同分异构体中符合以下条件的有 种。
a.能使FeCl3溶液显紫色
b.能发生加聚反应
c.苯环上只有两个互为对位的取代基
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学实验练习卷(解析版) 题型:实验题
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
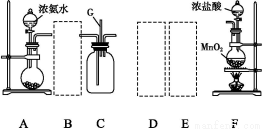
(1)装置F中发生反应的离子方程式为 。
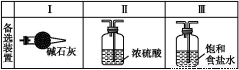
(2)装置A中的烧瓶内固体可选用 (填以下选项的代号)。
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B ,D ,E (均填编号)。
(4)氯气和氨气在常温下相混就会反应生成氯化铵和氮气,装置C内出现浓厚的白烟并在容器内壁凝结,请设计实验方案鉴定该固体就是氯化铵: 。
(5)从装置C的出气管口处逸出的尾气可能含有污染环境的气体,如何处理?
。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学反应原理练习卷(解析版) 题型:填空题
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
ΔH=-196.6 kJ/mol。

请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)ΔH2= 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣ (填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 ,若溶液中发生了氧化还原反应,则该过程的离子方程式为 。
(5)恒容条件下,下列措施中能使n(SO3)/ n(SO2)增大的有 。
a.升高温度
b.充入He气
c.再充入1 mol SO2(g)和1 mol O2(g)
d.使用催化剂
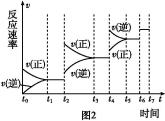
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修3物质结构与性质练习卷(解析版) 题型:选择题
PH3是一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断中错误的是( )
A.PH3分子呈三角锥形
B.PH3分子是极性分子
C.PH3沸点低于NH3沸点,因为P—H键键能低
D.PH3分子稳定性低于NH3分子,因为N—H键键能高
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修2化学与技术练习卷(解析版) 题型:选择题
工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法正确的是( )
选项污染物处理措施方法类别
A废酸加生石灰中和物理法
BCu2+等重金属离子加硫酸盐沉降化学法
C含苯废水用活性炭吸附物理法
D含纯碱的废水加石灰水反应化学法
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题6原子结构化学键练习卷(解析版) 题型:选择题
下列叙述中正确的是( )
A.以共价键形成的单质中只存在非极性键,以共价键形成的化合物中只存在极性键
B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同
C.PCl3和Na2O2中各原子或离子最外层都满足8电子稳定结构
D.24Mg34S晶体中电子总数与中子总数之比为1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com