
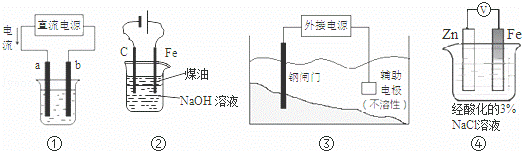
关于下列各装置图的叙述中,不正确的是( )
|
| A. | 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
|
| B. | 用图②装置实验室制备白色Fe(OH)2 |
|
| C. | 装置③中钢闸门应与外接电源的正极相连 |
|
| D. | 装置④中电子由Zn流向Fe,Zn极发生氧化反应 |
| 原电池和电解池的工作原理. | |
| 专题: | 电化学专题. |
| 分析: | A、根据电流的方向判断电源的正负极,精炼铜时粗铜做阳极; B、该装置中,铁电极反应式为Fe﹣2e﹣=Fe 2+,阴极上电极反应式为2H2O+2e﹣=H2↑+2OH﹣,Fe2+和OH﹣生成Fe(OH)2. C、装置③为外加电源的阴极保护法,钢闸门应与外接电源的负极相连; D、锌比铁活泼,为原电池的负极. |
| 解答: | 解:A、根据电流的方向可知a为电解池的阳极,则用来精炼铜时,a极为粗铜,电解质溶液为CuSO4溶液,故A正确; B、该装置中,铁电极反应式为Fe﹣2e﹣=Fe 2+,阴极上电极反应式为2H2O+2e﹣=H2↑+2OH﹣,Fe2+和OH﹣生成Fe(OH)2,煤油密度小于水,所以煤油能起到隔绝空气作用,防止氢氧化亚铁被氧化,故B正确; C、装置③为外加电源的阴极保护法,钢闸门与外接电源的负极相连,电源提供电子而防止铁被氧化,故C错误; D、锌比铁活泼,为原电池的负极,所以装置④中电子由Zn流向Fe,Zn极发生氧化,故D正确; 故选C. |
| 点评: | 本题考查原电池和电解池的工作原理,题目难度不大,本题易错点为B,注意煤油能起到隔绝空气作用,防止氢氧化亚铁被氧化. |


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:
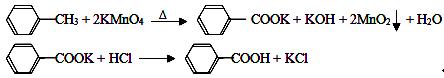
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
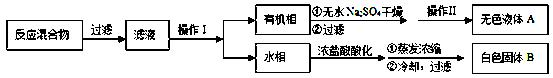
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是
。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶 解, | 得到白色晶体和无色溶液 | ----------------- |
| ② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含Cl— |
| ③ | 干燥白色晶体, | 熔点为122.4℃ | 白色晶体是苯甲酸 |
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10—3mol,产品中苯甲酸质量分数为 (保留二位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示。下列说法正确的是( )
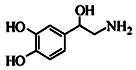
A.每个去甲肾上腺素分子中含有3个酚羟基
B.1mol去甲肾上腺素最多能与2molBr2
C.甲肾上腺素分子不能与饱和的碳酸氢钠溶液发生反应
D.去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
pH=5的氯化镁溶液中含有杂质氯化铁,为除去该杂质,可加入的试剂是( )
①MgO ②MgCO3 ③NaOH ④Na2CO3
A.①② B.②③ C.③④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
关于如图所示装置的叙述,正确的是( )

A. 铜是阳极,铜片上有气泡产生
B. 盐桥中的阳离子会移向CuSO4溶液
C. 正极附近的SO42﹣离子浓度逐渐增大
D. 锌离子在锌片表面被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
|
| A. | 正极反应式:Ag+Cl﹣﹣e﹣=AgCl |
|
| B. | 每生成1mol Na2Mn5O10转移2mol电子 |
|
| C. | Na+不断向“水”电池的负极移动 |
|
| D. | AgCl是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.强电解质溶液一定比弱电解质溶液的导电性强
B.强电解质的稀溶液中不存在溶质分子
C.强电解质都是离子化合物,而弱电解质都是共价化合物
D.不同的弱电解质只要物质的量的浓度相同,电离程度也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是______→______→______→D→______(均用字母填写)。
(2)滴定管的读数应注意
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)E中在锥形瓶下垫一张白纸的作用是
________________________________________________________________________
________________________________________________________________________。
(1) D步骤中液面应调节到
________________________________________________________________________
__________,尖嘴部分应__________________________________________________。
(2) 滴定终点时锥形瓶内溶液的pH约为_____________________________________,
终点时颜色变化是_______________________________________________________。
(6)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?______(填“偏高”、“偏低”或“不变”)。
(7)该烧碱样品纯度的计算式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是________________________________________________________________________________________________________________________________________________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是__________________________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有
________________________________________________________________________________________________________________________________________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中V1________,V6________,V9________;
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com