
氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池.氢镍电池的总反应式是: .根据此反应式判断,下列叙述正确的是
.根据此反应式判断,下列叙述正确的是
[ ]
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,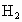 发生反应的电极为负极
发生反应的电极为负极
|
本题考查三方面的内容,一是电极反应类型的判定,二是溶液 pH的判定,三是正、负电极的判定.关于溶液pH的判定有两种思维:(1)由电极反应来看,负极: ;正极: ;正极:
 减少,pH减小;正极产生 减少,pH减小;正极产生 ,pH增大.(2)由电解质溶液中电荷的移动方向分析:阳离子向正极移动,阴离子( ,pH增大.(2)由电解质溶液中电荷的移动方向分析:阳离子向正极移动,阴离子( )向负极移动.负极区 )向负极移动.负极区 增多,pH增大,正极区 增多,pH增大,正极区 减少pH减小.以上两种思维得出了相反的结论,谁是矛盾的主要方面,谁就起决定作用.事实上,电极反应快,单位时间内产生的 减少pH减小.以上两种思维得出了相反的结论,谁是矛盾的主要方面,谁就起决定作用.事实上,电极反应快,单位时间内产生的 多; 多; 移动的慢,单位时间内转移的 移动的慢,单位时间内转移的 少;前一种思维起决定作用.分析这类问题,甚至可将后一种思维忽略.由此看来,A选项错误.不论充电还是放电,若反应结果是元素化合价升高,则该元素一定被氧化,发生的是氧化反应;若反应结果是元素化合价降低,则该元素一定被还原,发生的是还原反应.由此看来,B选项错误,C选项正确.原电池工作时,电子由负极流出,负极上应有失电子的物质,或失电子的物质所在的电极一定是负极.故D选项正确. 少;前一种思维起决定作用.分析这类问题,甚至可将后一种思维忽略.由此看来,A选项错误.不论充电还是放电,若反应结果是元素化合价升高,则该元素一定被氧化,发生的是氧化反应;若反应结果是元素化合价降低,则该元素一定被还原,发生的是还原反应.由此看来,B选项错误,C选项正确.原电池工作时,电子由负极流出,负极上应有失电子的物质,或失电子的物质所在的电极一定是负极.故D选项正确. |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
 Ni(OH)2根据此反应式判断,下列叙述中正确的是( )
Ni(OH)2根据此反应式判断,下列叙述中正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 H2+2NiO(OH).根据此反应式判断,下列叙述中正确的是( )
H2+2NiO(OH).根据此反应式判断,下列叙述中正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池充电时,阴极反应为Ni(OH)2+OH--e-![]() NiO(OH)+H2O
NiO(OH)+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,H2是负极
查看答案和解析>>
科目:高中化学 来源: 题型:
氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是![]() H2+NiO(OH)
H2+NiO(OH) ![]() Ni(OH)2。根据此反应式判断,下列叙述中正确的是
Ni(OH)2。根据此反应式判断,下列叙述中正确的是
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,H2是负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com