
A、羟基乙酸(HOCH2COOH)的缩聚物: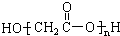 |
B、H2O2的分子结构模型示意图: |
| C、在CS2、PCl5中各原子最外层均能达到8电子的稳定结构 |
| D、淀粉和纤维素的实验式都为 CH2O |
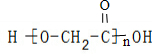 ,故A错误;
,故A错误; ,故B正确;
,故B正确;

科目:高中化学 来源: 题型:
| A、NaHCO3溶液与足量Fe2(SO4)3溶液反应:Fe3++3HCO3-═Fe(OH)3↓+3CO2↑ |
| B、足量NaOH溶液与NH4HS溶液反应:OH-+NH4+═NH3?H2O |
| C、向Br2水中加入少量的Na2SO3溶液:Br2+SO32-+H2O═SO42-+2H++2Br- |
| D、在氯化钙溶液中通入少量的二氧化碳:Ca2++CO2+H2O═CaCO3↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.186 | 0.089 | 0.074 | 0.099 |
| 主要化合价 | +1 | +2 | -2 | +7、-1 |
| A、X、Y元素的金属性:X<Y |
| B、X、Z形成的化合物中一定不含共价键 |
| C、W的最高价氧化物的水化物是一种强酸 |
| D、离子半径:X+>Z2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
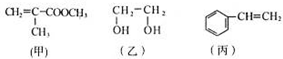 “神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.如图甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法中,错误的是( )
“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.如图甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法中,错误的是( )| A、甲物质可以在引发剂作用下生成有机高分子化合物 |
| B、1mol乙物质可与2mol钠完全反应生成1mol氢气 |
| C、丙物质能够使酸性高锰酸钾溶液退色 |
| D、甲、乙、丙三种物质都可以发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
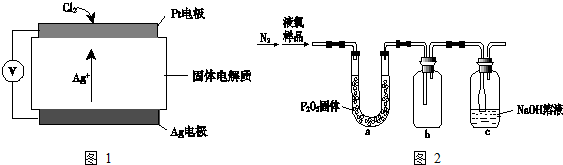
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温室效应是当今世界面临的环境问题,使温室效应增强的气体只有二氧化碳 |
| B、直馏汽油、裂化汽油、植物油、甘油均能与溴发生加成反应而使溴的四氯化碳溶液褪色 |
| C、PX(对二甲苯)是制造聚酯纤维的原料,它是一种难溶于水密度比水大的剧毒物质 |
| D、晶体硅可用于制作太阳能电池板,二氧化硅可用于制作光导纤维 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com