
一定条件下用甲烷可以消除氮氧化物(NOx)的污染.已知:
①CH4( g )+4NO2( g )═4NO( g )+CO2( g )+2H2O( g )△H=﹣574kJ•mol﹣1
②CH4( g )+4NO( g )═2N2( g )+CO2( g )+2H2O( g )△H=﹣1160kJ•mol﹣1.
下列正确的选项是( )
|
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=﹣867kJ•mol﹣1 |
|
| B. | CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子总数为3.2mol |
|
| C. | 若0.2mol CH4还原NO2至N2,在上述条件下放出的热量为173.4kJ |
|
| D. | 若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为3.2mol |
| 用盖斯定律进行有关反应热的计算;氧化还原反应的电子转移数目计算;有关反应热的计算. | |
| 专题: | 化学反应中的能量变化. |
| 分析: | A、由反应①+②可得到2CH4(g)+4NO2(g)═2N2(g)+2CO2(g)+4H2O( g ),再利用化学计量数与反应热成正比来计算; B、x=1.6,1molNOx中NO2、NO分别为0.6mol、0.4mol,转移的电子数为0.6mol×(4﹣0)+0.4mol×(2﹣0); C、利用热化学反应方程式中化学计量数与反应热的关系来计算; D、利用n= |
| 解答: | 解:A、反应①+②可得到2CH4(g)+4NO2(g)═2N2(g)+2CO2(g)+4H2O( g ),△H=(﹣574kJ•mol﹣1)+(﹣1160kJ•mol﹣1)=﹣1734kJ•mol﹣1, 则CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O( g )△H=﹣867kJ•mol﹣1,若生成液态水,则放出的热量大于 867KJ,故A错误; B、x=1.6,1molNOx中NO2、NO分别为0.6mol、0.4mol,转移的电子数为0.6mol×(4﹣0)+0.4mol×(2﹣0)=3.2mol,但该反应中NOx的物质的量不确定,则转移的电子数不确定,故B错误; C、由CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O( g )△H=﹣867kJ•mol﹣1,放出的热量为0.2mol×867kJ•mol﹣1=173.4kJ,故C正确; D、甲烷的物质的量为 故选C. |
| 点评: | 本题考查学生利用盖斯定律来计算反应的反应热,并学会利用化学计量数与反应热的关系、利用化合价的变化分析电子转移的数目来就解答即可. |


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
金属a、b的活泼性均比氢强,a还可以从b的硝酸盐中置换出b。将a、b用导线相连放入CuSO4溶液,下列叙述中不正确的是( )
A.导线上有电流,电流方向由b向a
B.a极质量减小,b极质量增加
C.b极上放出氢气
D.a极发生氧化反应,b极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
绿色化学的核心是反应过程的绿色化,要求原料物质中的所有原子完全被利用且全部转入期望的产品中.下列过程不符合这一思想的是( )
|
| A. | 甲烷、CO合成乙酸乙酯:2CH4+2CO |
|
| B. | 烯烃与水煤气发生的羰基合成反应:RCH=CH2+CO+H2 |
|
| C. | 乙醇被氧气催化氧化成乙醛 |
|
| D. | 氯乙烯合成聚氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是( )
|
| A. | HCl和NaOH反应的中和热△H=﹣57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol |
|
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+566.0kJ/mol |
|
| C. | 需要加热才能发生的反应一定是吸热反应 |
|
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
足量镁粉与一定量的盐酸反应,由于反应速率太快,为减慢反应速率,但并不影响氢气产生的总量,可以加入下列物质中的( )
|
| A. | MgO | B. | NaOH | C. | K2CO3 | D. | CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式H2(g)+F2(g)═2HF(g)△H=﹣270kJ•mol﹣1,下列说法中错误的是( )
|
| A. | 在上述条件下,44.8L氟化氢气体分解成22.4L氢气与22.4L氟气吸收270kJ热量 |
|
| B. | 在上述条件下,1mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量大于270kJ |
|
| C. | 在上述条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 |
|
| D. | 上述热化学方程式还可表示为: |
查看答案和解析>>
科目:高中化学 来源: 题型:
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
| ② | 20mL 0.2mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
(1)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是 > (填实验序号).
(2)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速 率变快的主要原因可能是:①该反应放热、② .

查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:(1)B、C、D三种元素的电负性由小到大的顺序为 ,E的基态原子的电子排布式为 。(2)由B、D形成的BD32-离子中,其VSEPR模型名称是 ,离子的中心原子采用 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
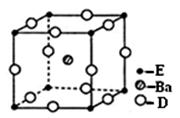 (4)D、E和钡三种元素构成的某化合物的晶胞结构如右图所示,该化合物的化学式为 。纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
(4)D、E和钡三种元素构成的某化合物的晶胞结构如右图所示,该化合物的化学式为 。纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com