
【题目】T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
元索 | 相关信息 |
T | T元素可形成自然界硬度最大的单质 |
W | W与T同周期,核外有一个未成对电子 |
X | X原子的第一离能至第四电离能分别I1=578 kJ/mol; I2= l817 kJ/mol; I3=2745 kJ/mol;I4=11575kJ/mol |
Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
Z | Z的一种同位素的质量数为63,中子数为34 |
(1)TY2的结构式是__________是__________(填“极性分子”或“非极性分子”),1mol该分子中存在________个σ键。

(2)基态Y原子中,电子占据的最高能层符号为__________,该能层具有的原子轨道数为_____________、电子数为_________。Y、氧、W元素的电负性由大到小的顺序为_________(用元素符号作答)。
(3)已知Z的晶胞结构如图所示,又知Z的密度为a g/cm3,则Z 的半径为___________pm;ZYO4常作电镀液,其中YO42-的等电子体是__________,其中Y原子的杂化轨道类型是___________。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z +HCl+O2=ZC1+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是___________。
A.O2是氧化剂 B.HO2是氧化产物
C.HO2在碱中能稳定存在 D.1 mol Z参加反应有1 mol电子发生转移
【答案】 S=C=S 非极性分子 2NA M 9 6 F>O>S 21/2/4(4*64/NAa)1/3*1010 CCl4或ClO4- sp3 AD
【解析】T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大。依据题中信息可知,自然界硬度最大的单质为金刚石,所以T为6号的C、W为9号的F、X为13号的Al、Y为16号的S、Z为29号的Cu。
(1) 二氧化碳和二硫化碳是等电子体,类比二氧化碳可知,CS2的结构式是S=C=S,它是非极性分子,因为双键中只有一个键是σ键,所以1mol该分子中存在2NA个σ键。
(2)基态S原子中,电子占据的最高能层为第3电子层,符号为M,该能层具有的原子轨道是1个3s、3个3p、5个3d,总数为9,M层的电子数为6。硫、氧、氟元素的电负性由大到小的顺序为F>O>S。
(3)由铜的晶胞结构可知它是面心立方,每个晶胞中有4个铜原子(8![]() )。
)。![]() ,根据Z的密度为a g/cm3和摩尔质量可以求出该晶胞的边长为
,根据Z的密度为a g/cm3和摩尔质量可以求出该晶胞的边长为 cm=。在面心立方中,设边长为x,面对角线为4r,则2x2=(4r)2,解得x=2
cm=。在面心立方中,设边长为x,面对角线为4r,则2x2=(4r)2,解得x=2 ![]() ,则Z 的半径为
,则Z 的半径为 pm; SO42-的等电子体是CCl4或ClO4-,其中S原子的杂化轨道类型是sp3。由Cu +HCl+O2=CuC1+HO2,可知O2是氧化剂、1 mol Cu参加反应有1 mol电子发生转移,HO2是还原产物,因为它是自由基,所以HO2在碱中不能稳定存在。所以说法或表示正确的是AD。
pm; SO42-的等电子体是CCl4或ClO4-,其中S原子的杂化轨道类型是sp3。由Cu +HCl+O2=CuC1+HO2,可知O2是氧化剂、1 mol Cu参加反应有1 mol电子发生转移,HO2是还原产物,因为它是自由基,所以HO2在碱中不能稳定存在。所以说法或表示正确的是AD。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】“地沟油”是用饭店的泔水及垃圾猪肉等加工而成的“食用油”。下列有关说法中正确的是( )
A. “地沟油”的主要成分是蛋白质,还含有较多的微量元素
B. “地沟油”外观与普通食用油一样,经过处理的“地沟油”具有固定的熔沸点
C. “地沟油”在加入消泡剂后,消除了其对人体健康的影响
D. “地沟油”可用于生产生物柴油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验室制备乙酸乙酯的操作错误的是( )
A. 配料:加入过量乙醇B. 加热:用水浴加热
C. 分离:用边反应边分离的方法D. 净化:产物用氢氧化钠溶液洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L
B.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L
C.配制480 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾
D.10 g 98%的硫酸(密度为1.84 gcm﹣3)与10 mL18.4 molL﹣1的硫酸的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气是城市空气的主要污染物,如何减少汽车尾气(CO、NOx等)的污染是重要的科学研究课题。
(1)一定条件下的密闭容器中,进行反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是____(填字母)。
N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是____(填字母)。
A.NO的生成速率与NO的消耗速率相等 B.υ(CO)=υ(CO2)
C.体系的压强保持不变 D.各物质的浓度保持不变
(2)可用活性炭还原法处理氮氧化物。有关反应的化学方程式为:C(s)+2NO(g)![]() N2(g)+CO2(g)△H>0某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)△H>0某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L﹣1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
①写出该反应的平衡常数表达式:K=____________________。
②30min后,改变某一条件,平衡发生了移动,则改变的条件是_______________;若升高温度,NO浓度将_______(填“增大”、“不变”或“减小”)。
③计算从0~20min内,NO的平均反应速率为___________________。
(3)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:反应开始时正、逆反应速率的大小:υ(正)____υ(逆)(填“ >”、“ < ”或“=”)。
CH3OCH3(g)+CO2(g),若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:反应开始时正、逆反应速率的大小:υ(正)____υ(逆)(填“ >”、“ < ”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对一含有Al3+的未知溶液进行了如下分析:
(1)滴入少量氢氧化钠,无明显变化;
(2)继续滴加NaOH溶液,白色沉淀;
(3)滴入过量的氢氧化钠,白色沉淀明显减少。实验小组经定量分析,得出如图所示沉淀与滴入氢氧化钠体积的关系。下列说法错误的是
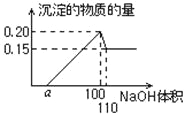
A. 该未知溶液中至少含有3种阳离子
B. 滴加的NaOH溶液的物质的量浓度为5mol·L-1
C. 若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
D. 若另一种离子为二价阳离子,则a=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。下表中所列出的 a、b物质不符合要求的是
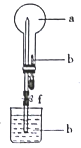
a(干燥气体) | b(液体) | |
A | NO2 | 水 |
B | SO2 | 饱和酸性高锰酸钾溶液 |
C | Cl2 | 饱和NaOH馆液 |
D | NH3 | 2 mol/L.盐酸 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com