
| A. | 析氢腐蚀 | B. | 牺牲阳极的阴极保护法 | ||
| C. | 吸氧腐蚀 | D. | 外加电流的阴极保护法 |
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 |
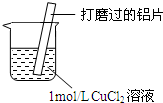 | ⅰ.红色物质附着于铝片表面 ⅱ.大量无色气体从红色物质表面逸出,放出大量的热 ⅲ.烧杯底部出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在温度不变时,水溶液中c(H+)和c(0H-)不能同时增大 | |
| B. | pH=3的盐酸和pH=5的硫酸等体积混合,pH=4 | |
| C. | 中性溶液中必然有c(H+)=c(0H-)=1×10-7mol/L | |
| D. | 在0.1mol/L HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯水振荡,观察水层是否有棕红色出现 | |
| B. | 滴入AgNO3溶液,再加入稀硝酸,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,然后加入稀硝酸使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Na+>Mg2+>Al3+>F- | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 | D. | 酸性强弱:H2SO4>H2CO3>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3常用于制造红色油漆和涂料 | B. | 水玻璃可用作木材的防火剂 | ||
| C. | 铝制容器可用于盛装稀硫酸 | D. | 碘化银可用于人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com