
【题目】在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,发生反应:SO2(g)+NO2(g)SO3(g)+NO(g).当达到平衡状态时,测得容器中SO2(g)的转化率为50%.
试求:该温度下、该容器中,再继续加入1mol的SO2(g),则:
(1)化学平衡将向方向移动,NO2的转化率将(填“增大”、“不变”或“减小”);
(2)经计算,当达到新的平衡状态时,容器中SO2(g)的浓度是mol/L;
(3)整个过程中,SO2的转化率由50%变为%,NO2的转化率由%变为%.
(4)计算结果给我们的启示是:增大一种反应物物的用量,其转化率将(填“增大”、“不变”或“减小”)另一反应物的转化率将(填“增大”、“不变”或“减小”).现实生产中的意义是:可以通过增大的用量,来提高成本高的反应物的利用率.
【答案】
(1)正反应;增大
(2)0.18
(3)40;50;60
(4)减小;增大;廉价反应物
【解析】解:(1)该温度下、该容器中,再继续加入1mol的SO2(g),平衡向正反应方向移动,NO2的转化率将增大,所以答案是:正反应;增大;(2)在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,转化的SO2为2mol×50%=1mol,则:
SO2(g) | + | NO2(g) | SO3(g) | + | NO(g) | ||
起始量(mol) | 2 | 2 | 0 | 0 | |||
转化量(mol) | 1 | 1 | 1 | 1 | |||
平衡量(mol) | 1 | 1 | 1 | 1 |
平衡时c(SO2)=c(NO2)=c(SO3)=c(NO)= ![]() =0.1mol/L,
=0.1mol/L,
平衡常数K= ![]() =
= ![]() =1
=1
再继续加入1mol的SO2(g),等效为开始加入3mol的SO2(g)和2mol的NO2(g),设平衡时容器中SO2(g)的浓度是xmol/L,则:
SO2(g) | + | NO2(g) | SO3(g) | + | NO(g) | ||
起始量(mol) | 0.3 | 0.2 | 0 | 0 | |||
转化量(mol) | 0.3﹣x | 0.3﹣x | 0.3﹣x | 0.3﹣x | |||
平衡量(mol) | x | x﹣0.1 | 0.3﹣x | 0.3﹣x |
所以 ![]() =1,解得x=0.18,所以答案是:0.18;(3)SO2、NO2起始物质的量之比为1:1,又按物质的量1:1反应,二者转化率相等,故NO2的转化率为50%;新平衡时SO2的转化率=
=1,解得x=0.18,所以答案是:0.18;(3)SO2、NO2起始物质的量之比为1:1,又按物质的量1:1反应,二者转化率相等,故NO2的转化率为50%;新平衡时SO2的转化率= ![]() ×100%=40%、NO2的转化率=
×100%=40%、NO2的转化率= ![]() ×100%=60%;所以答案是:40%;50%;60%;(4)增大一种反应物的用量,其转化率将减小,另一反应物的转化率将增大,现实生产中的意义是:可以通过增大低成本物质的用量,来提高成本高的反应物的利用率,
×100%=60%;所以答案是:40%;50%;60%;(4)增大一种反应物的用量,其转化率将减小,另一反应物的转化率将增大,现实生产中的意义是:可以通过增大低成本物质的用量,来提高成本高的反应物的利用率,
所以答案是:减小;增大;廉价反应物.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】下列做法错误但没有危险的是 ( )
A.制乙酸乙酯时,把乙醇和乙酸依次加入浓硫酸中
B.制乙烯时,为防止暴沸,往热反应液中加入沸石
C.进行H2还原CuO的实验时, 先加热CuO后通入H2
D.进行硫酸铜晶体含水量测定实验时,加热后的坩埚冷却过程未放入干燥器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4CO(g)+2NO2(g)N2(g)+4CO2(g)开始进行时,CO的浓度为4mol/L,N2的浓度为0,2min后测得N2的浓度为0.6mol/L,则此段时间内,下列反应速率表示正确的是( )
A.v(CO)=1.2 mol/(Ls)
B.v(NO2)=0.3 mol/(Lmin)
C.v(N2)=0.6 mol/(Lmin)
D.v(CO2)=1.2 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)CO2(g)+H2(g),部分数据见下表(表中t2>t1):
反应时间/min | N(CO)/mol | H2O/mol | N(CO2)/mol | N(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)= ![]() mol?L﹣1?min﹣1
mol?L﹣1?min﹣1
B.平衡时CO的转化率为66.67%
C.该温度下反应的平衡常数为1
D.其他条件不变,若起始时n(C0)=0.60 mol,n(H20)=1.20 mol,则平衡时n(C02)=0.20 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中不正确的是( ) 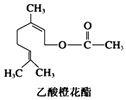
A.分子式为C12H20O2
B.1 mol该有机物水解时只能消耗1 mol NaOH
C.1mol该有机物可消耗3molH2
D.不能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁二酮肟 ![]() 是检验Ni2+的灵敏试剂.
是检验Ni2+的灵敏试剂.
(1)Ni2+基态核外电子排布式为 . 丁二酮肟分子中C原子轨道杂类型为 , 1mol丁二酮肟分子所含σ键的数目为 .
(2)Ni能与CO形成四羰基镍[Ni(CO)4],四羰基镍熔点﹣19.3℃,沸点42.1℃,易溶于有机溶剂.
①Ni(CO)4固态时属于晶体(填晶体类型).
②与CO互为等电子体的阴离子为(填化学式).
(3)Ni2+与Mg2+、O2﹣形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中除杂所选用的试剂及操作方法均正确的组合是(括号内为杂质)
待提纯的物质 | 选用的试剂 | 操作方法 | |
A | I2(水) | 乙醇 | 萃取、分液 |
B | CO2 (CO) | O2 | 点燃 |
C | Zn (Cu) | 稀硫酸 | 过滤 |
D | 乙醇(水) | 生石灰 | 蒸馏 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.在20℃,1.01×105Pa时,22.4L甲烷(CH4)所含的原子数为5NA
B.常温常压下,28g氮气所含的原子数为2NA
C.标准状况下,22.4L水所含有的分子数目为NA
D.0.5mol H2O所含的电子数目为9 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com