
| A、放在棕色瓶中 |
| B、放在CCl4中 |
| C、放在水中 |
| D、放在煤油中 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
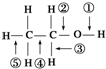 乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )
乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )| A、和金属钠反应时键①断裂 |
| B、在铜催化共热下与O2反应时断裂①和③ |
| C、在铜催化共热下与O2反应时断裂①和⑤ |
| D、在空气中完全燃烧时断裂①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 应称量NaOH的质量/g | 已给仪器 | 除已给仪器外还需要的其他仪器 |
| 烧杯、药匙、 托盘天平 |
查看答案和解析>>
科目:高中化学 来源: 题型:
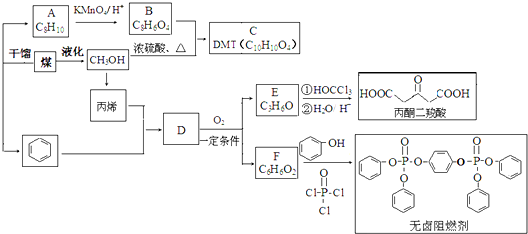
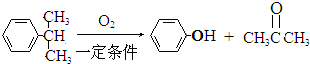
| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32.64 g |
| B、65.28 g |
| C、3.84 g |
| D、38.4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com