
【题目】明矾石经处理后得到明矾(KAl(SO4)2·12H2O)。由明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
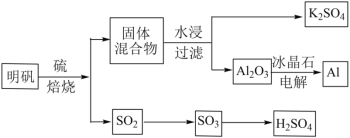
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂和还原剂的物质的量之比为_______。
(2)从水浸后的滤液中得到K2SO4晶体的操作方法是_______。
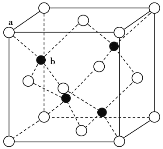
(3)A12O3在一定条件下可制得AIN,AlN的晶体结构与金刚石相似,晶胞结构如图所示。每个晶胞中含有_______个铝原子,若Al与N原子最近距离为apm,则该晶体的密度为_______g/cm3。(阿伏加德罗常数用NA表示)
(4)SO2分子的空间构型为_______
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时
2SO2(g)+O2(g)![]() 2SO3(g)△H1=一197kJ/mol;
2SO3(g)△H1=一197kJ/mol;
2H2O(g)=2H2O(1)△H2=一44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是_______。
【答案】1:1 蒸发浓缩,冷却结晶 4 ![]() V形或角形 SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ·mol-1
V形或角形 SO3(g)+H2O(l)=H2SO4(l)△H=-152kJ·mol-1
【解析】
(1)根据焙烧明矾方程式,判断出氧化剂和还原剂,即可知道答案;
(2)从溶液中得到固体硫酸钾,可以才用蒸发结晶的方法;
(3)AlN的晶胞中N原子数目为4,Al原子数目为8×![]() +6×
+6×![]() =4,顶点白色球与相邻黑色距离为晶胞体对角线的
=4,顶点白色球与相邻黑色距离为晶胞体对角线的![]() ,则晶胞体对角线长为4apm,晶胞棱长为
,则晶胞体对角线长为4apm,晶胞棱长为![]() pm,晶胞的体积为(
pm,晶胞的体积为(![]() pm)3,1mol晶胞的质量为4×41g,得其密度;
pm)3,1mol晶胞的质量为4×41g,得其密度;
(4) SO2分子中S原子价层电子对数=2+![]() =3,且含有1个孤电子对,根据价电子对互斥理论判断S原子的轨道杂化类型及分子的空间构型;
=3,且含有1个孤电子对,根据价电子对互斥理论判断S原子的轨道杂化类型及分子的空间构型;
(5) ①2SO2(g)+O2(g)2SO3(g)△H1=-197kJ/mol,②2H2O(g)=2H2O(1)△H2=-44kJ/mol,③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ/mol,依据盖斯定律③-①-②得到。
(1)4KAl(SO4)212H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应硫单质中硫元素化合价升高为+4价。硫酸根离子中硫元素化合价从+6价变化为+4价,故还原剂是硫单质,而氧化剂是6mol的硫酸根离子,即3mol的4KAl(SO4)212H2O,氧化剂和还原剂的物质的量之比1:1,故答案为1:1;
(2)从溶液中得到固体硫酸钾,可以才用蒸发结晶的方法,故答案:蒸发浓缩,冷却结晶;
(3)AlN的晶胞中N原子数目为4,Al原子数目为8×![]() +6×
+6×![]() =4,顶点白色球与相邻黑色距离为晶胞体对角线的
=4,顶点白色球与相邻黑色距离为晶胞体对角线的![]() ,则晶胞体对角线长为4apm,晶胞棱长为
,则晶胞体对角线长为4apm,晶胞棱长为![]() pm,晶胞的体积为(
pm,晶胞的体积为(![]() pm)3,1mol晶胞的质量为4×41g,得其密度
pm)3,1mol晶胞的质量为4×41g,得其密度![]() g/cm3,故答案为:4;
g/cm3,故答案为:4;![]() ;
;
(4)SO2分子中S原子价层电子对数=2+![]() =3,且含有1个孤电子对,根据价电子对互斥理论判断S原子的轨道杂化类型为sp2,分子的空间构型为V形,故答案为:V形或角形;
=3,且含有1个孤电子对,根据价电子对互斥理论判断S原子的轨道杂化类型为sp2,分子的空间构型为V形,故答案为:V形或角形;


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】月球上的每百吨He聚变所释放出的能量相当于目前人类一年消耗的能量,地球上氦元素主要以He的形式存在。已知一个12C原子的质量为a g,一个He原子的质量为b g,NA为阿伏加德罗常数。下列说法正确的是
A.He比H多一个中子B.氦元素的近似相对原子质量为3
C.He的相对原子质量为![]() D.He的摩尔质量为bNA
D.He的摩尔质量为bNA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示某硅氧离子的空间结构示意图(虚线不表示共价键)。通过观察分析,下列叙述正确的是( )
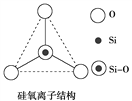
A. 键角为120° B. 化学组成为SiO![]()
C. Si原子采用sp2轨道杂化方式 D. 化学组成为SiO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
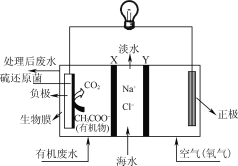
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4 kJ/mol,其化学平衡常数K与温度t的关系如下表:
2NH3(g)△H=-92.4 kJ/mol,其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | ...... |
K/(mol/L)2 | 4.1×106 | K1 | K2 | ...... |
完成下列问题:
①比较K1、K2的大小:K1_______K2(填“>”、“=”或“<”);
②在恒温恒压下判断该反应达到化学平衡状态的依据是_______(填序号);
A 2v(H2)(正)=3v(NH3)(逆)
B 2v(N2)(正)=v(H2)(逆)
C 容器内压强保持不变
D 混合气体的密度保持不变
(2)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,反应达到平衡时,c(NH3)=0.5mol·L-1,则该反应的平衡常数K=_______。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的v正_______v逆(填“>”“<”或“=”)。
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6molNH3和3molCO2,反应达到平衡时,c(NH3)=0.5mol·L-1,则该反应的平衡常数K=_______。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的v正_______v逆(填“>”“<”或“=”)。
(3)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。
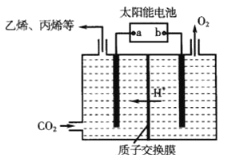
①该工艺中能量转化方式主要有_______。
②电解时,生成乙烯的电极反应式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是_________。
(2)混合气体的平均摩尔质量是_________。
(3)CO2和CO的体积之比是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图装置(夹持装置略)制备高效水处理剂高铁酸钾(K2FeO4)并探究其性质。
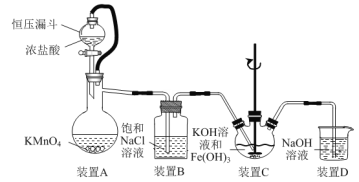
已知K2FeO4具有下列性质:①可溶于水,微溶于浓KOH溶液;②在0℃~5℃、强碱性溶液中比较稳定,在Fe(OH)3或Fe3+催化下发生分解;③在弱碱性至酸性条件下,能与水反应生成O2和Fe(OH)3(或Fe3+)。
(1)装置A用于制取氯气,其中使用恒压漏斗的原因是____。
(2)为防止装置C中K2FeO4分解,可以采取的措施是____和____。
(3)装置C中生成K2FeO4反应的离子方程式为____。
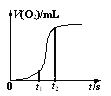
(4)用一定量的K2FeO4处理饮用水,测得产生O2的体积随时间的变化曲线如图所示。t1 s~t2 s内,O2的体积迅速增大的主要原因是____。
(5)验证酸性条件下氧化性FeO42->Cl2的实验方案为:取少量K2FeO4固体于试管中,____。(实验中须使用的的试剂和用品有:浓盐酸,NaOH溶液、淀粉KI试纸、棉花)
(6)根据K2FeO4的制备实验得出:氧化性Cl2>FeO42-,而第(5)小题实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中有如下反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-906 kJ·mol-1,下列叙述正确的是
4NO(g)+6H2O(g) ΔH=-906 kJ·mol-1,下列叙述正确的是
A. 2 mol NH3和5 mol O2充分反应,达到平衡时放出热量为453 kJ
B. 平衡时5v正(O2)=4v逆(NO)
C. 平衡后降低温度,混合气体中NH3含量减小
D. 平衡后减小压强,混合气体平均摩尔质量增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com