
有4.8g![]() 混合物,在灼热条件下与充足的CO进行反应,反应后的气体用0.6mol/L
混合物,在灼热条件下与充足的CO进行反应,反应后的气体用0.6mol/L![]() 溶液100mL吸收,有白色沉淀生成.又知反应后固体的质量为3.52g.下列叙述中正确的是
溶液100mL吸收,有白色沉淀生成.又知反应后固体的质量为3.52g.下列叙述中正确的是
[ ]
A.原混合物中![]() 与
与![]() 的物质的量之比为1:1
的物质的量之比为1:1
B.生成的![]() 恰好被
恰好被![]() 溶液完全吸收,
溶液完全吸收,![]() 沉淀完全
沉淀完全
C.在吸收![]() 的溶液中可能有
的溶液中可能有![]()
D.原混合物中![]() 与
与![]() 的质量比是2:1
的质量比是2:1
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 编号 | V (Na2CO3)/mL | 沉淀情况 |
| 1 | 2.8 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 |
| 3 | 2.0 | 较多、绿色 |
| 4 | 1.6 | 较少、绿色 |
| 编号 | 反应温度/℃ | 沉淀情况 |
| 1 | 40 | 多、蓝色 |
| 2 | 60 | 少、浅绿色 |
| 3 | 75 | 较多、绿色 |
| 4 | 80 | 较多、绿色(少量褐色) |

查看答案和解析>>
科目:高中化学 来源:高中化学习题1 题型:021
有4.8g ![]() 混合物,在灼热条件下与充足的CO进行反应,反应后的气体用0.6mol/L
混合物,在灼热条件下与充足的CO进行反应,反应后的气体用0.6mol/L ![]() 溶液100mL吸收,有白色沉淀生成.又知反应后固体的质量为3.52g.下列叙述中正确的是
溶液100mL吸收,有白色沉淀生成.又知反应后固体的质量为3.52g.下列叙述中正确的是
[ ]
A.原混合物中![]() 与
与![]() 的物质的量之比为1∶1
的物质的量之比为1∶1
B.生成的![]() 恰好被
恰好被![]() 溶液完全吸收,
溶液完全吸收,![]() 沉淀完全
沉淀完全
C.在吸收![]() 的溶液中可能有
的溶液中可能有![]()
D.原混合物中![]() 与
与![]() 的质量比是2∶1
的质量比是2∶1
查看答案和解析>>
科目:高中化学 来源:高中化学同步单元练习册第一册(高一年级) 题型:038
试管内有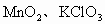 的混合物,充分加热后质量减少4.8g.将试管的残留物与过量浓盐酸反应,产生的
的混合物,充分加热后质量减少4.8g.将试管的残留物与过量浓盐酸反应,产生的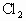 在标准状况下为1.12L.问:反应中有多少摩HCl被氧化?原混合物经充分加热,有多少摩氧化剂被还原?原混合物的质量共多少克?
在标准状况下为1.12L.问:反应中有多少摩HCl被氧化?原混合物经充分加热,有多少摩氧化剂被还原?原混合物的质量共多少克?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com