
【题目】短周期主族元素A、B、C、D、E的原子序数依次增大,其单质常温下有三种气态两种固态,A和B形成的气态化合物的水溶液可使红色石蕊试纸变蓝,A和C同主族,D原子最外层电子数与电子层数相等,E的原子半径在同周期最小,下列说法不正确的是:
A. 原子半径大小:r(D) > r(E)
B. C和氧元素形成的化合物可能含有非极性键
C. E形成的单质具有漂白性
D. C、D的最高价氧化物对应的水化物之间能发生反应
【答案】C
【解析】
短周期主族元素A、B、C、D的原子序数依次增大,A和B形成的气态化合物的水溶液呈碱性,该气体为![]() ,结合原子序数大小,可推知A为氢元素、B为N元素;A和C同主族,C的原子序数大于N,则C为Na;D原子序数大于Na,处于第三周期,D原子最外层电子数与电子层数相等,则D为Al,E的原子半径在同周期最小,则E为Cl。综上所述A为H,B为N,C为Na,D为Al,E为Cl。
,结合原子序数大小,可推知A为氢元素、B为N元素;A和C同主族,C的原子序数大于N,则C为Na;D原子序数大于Na,处于第三周期,D原子最外层电子数与电子层数相等,则D为Al,E的原子半径在同周期最小,则E为Cl。综上所述A为H,B为N,C为Na,D为Al,E为Cl。
A. 同周期元素,从左到右原子半径依次减小,故A正确;
B. C和氧形成的化合物有![]() 和
和![]() ,
,![]() 中含有非极性键,故B正确;
中含有非极性键,故B正确;
C. 干燥的氯气不具有漂白性,氯水具有漂白性,故C错误;
D. C、D的最高价氧化物对应水化物分别为NaOH和![]() ,
,![]() 可以跟NaOH溶液反应,故D正确;
可以跟NaOH溶液反应,故D正确;
故答案选C。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】废旧光盘金属层中含有金属Ag(其它金属微量忽略不计),从光盘中提取金属 Ag 的工艺流程如下。请回答下列问题。

(1)“氧化”阶段需在 80 ℃ 条件下进行,使用的加热方式为______________________。
(2)NaClO溶液与Ag 反应的产物为AgCl、NaOH 和O2,该反应的化学方程式为____________。有人提出用HNO3代替 NaClO氧化Ag,从反应产物的角度分析,其缺点是______________。
(3)“过滤Ⅰ”中洗涤难溶物的实验操作为_____________________________________。
(4)常用10%的氨水溶解AgCl固体, AgCl与 NH3H2O按 1:2 反应可生成 Cl-和一种阳离子_____(填阳离子的化学式)的溶液。实际反应中,即使氨水过量,“废渣”中也含有少量AgCl固体,可能的原因是__________________________________________。
(5)理论上消耗 0.1 mol N2H4H2O可“还原”得到_____ g Ag的单质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入_______________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用如图装置 来测定过氧化钠的质量分数。

①A中发生反应离子方程式为___________________
②将仪器连接好以后,必须进行的第一步操作是__________
③写出装置C中发生的所有反应的化学方程式______________________________,_______________________________________________________
④D中NaOH溶液的作用__________________________
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分 数为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。已知:K2FeO4易溶于水、微溶于浓碱溶液,不溶于乙醇,在0~5 ℃的强碱性溶液中较稳定。实验室中常用KClO在强碱性介质中与Fe(NO3)3反应制备K2FeO4(夹持装置略去)。回答下列问题:
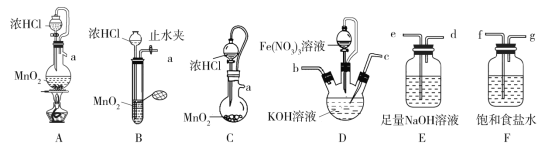
(1)盛放Fe(NO3)3溶液的仪器名称为______________________。
(2)氯气的发生装置可以选择图中的________(用图中大写字母表示);检查装置B气密性的操作为___________。
(3)选择上述装置,制备K2FeO4,按气流从左到右的方向,合理的连接顺序a→______(填仪器接口字母,仪器不可重复使用)。
(4)装置D中生成K2FeO4的离子方程式为__________;实验过程中若装置D的液面上方出现黄绿色气体后,再滴加Fe(NO3)3溶液会产生大量红褐色沉淀,用必要的文字和离子方程式分析原因:_______________
(5)制备的高铁酸钾粗产品中含有KNO3、KCl、Fe(OH)3等杂质,请将以下提纯步骤补充完整,(实验药品:高铁酸钾粗产品、蒸馏水、乙醇、饱和NaOH溶液、饱和KOH溶液、冷的稀KOH溶液、冰水)。
①取一定量的高铁酸钾粗产品,溶于_____________;
②过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液;
③搅拌、静置、过滤,用____________洗涤2~3次,在真空干燥箱中干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
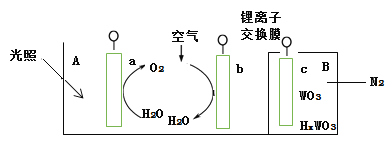
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL0.lmol/LNH4Cl溶液中,逐滴滴加0.1mol/LNaOH溶液。NH4+和NH3H2O的变化趋势如图所示(不考虑生成NH3,已知NH3H2O的kb=1.8![]() 10-5),下列说法正确的是( )
10-5),下列说法正确的是( )

A.a=0.005
B.在M点时,n(H+)—n(OH—)=(0.005—a)mol
C.随着NaOH溶液的滴加, 不断增大
不断增大
D.当n((NaOH)) =0.01 mol 时,c ((NH3H2O)![]() c (Na+)
c (Na+)![]() c (OH-)
c (OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
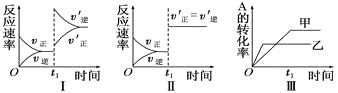
A. 图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响
B. 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
D. 图Ⅲ表示的是不同催化剂对平衡的影响,且甲的催化效率比乙高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是

A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求填写下列空白:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________________________________________;
(2)写出元素②的最简单氢化物的结构式_________________________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com