
| A、乙酸所有原子处于同一平面,含有羧基,可与NaHCO3溶液反应生成CO2 |
| B、苯、乙醇和乙酸都能发生取代反应,乙酸乙酯和食用植物油均可水解生成乙醇 |
| C、乙烯、苯和聚乙烯都能使溴水褪色,褪色的原因相同 |
| D、在烃类有机物分子中,含有的氢原子个数一定是偶数 |


科目:高中化学 来源: 题型:
 FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 25℃平衡体系(苯、水HA) | 平衡常数 | 焓变 | 起始总浓度 |
| 在水中,HA?H++A- | K1 | △H1 | 3.0×10-3mol?L-1 |
| 在苯中,2HA?(HA)2 | K2 | △H2 | 4.0×10-3mol?L-1 |
| c[(HA)2] |
| c2(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤经过气化和液化两个物理变化,可变为清洁能源 |
| B、古代的陶瓷、砖瓦,现代的有机玻璃、水泥都是硅酸盐产品 |
| C、明矾可用于水的消毒、杀菌:碳酸钡可用于钡餐透视 |
| D、单晶硅太阳能电池板可以将太阳能直接转变为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,C12可在甲苯的苯环或侧链上发生取代反应 |
B、2-甲基丙烯的结构简式: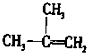 |
| C、乙醇和乙烯的混合物l mol,完全燃烧消耗3 mol O2 |
| D、光照下2,2-二甲基丁烷与Br2反应,其一溴取代物只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝热剂就是单指Fe2O3粉和铝粉的混合物 |
| B、检验红砖中的红色物质是否是Fe2O3的操作步骤是:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
| C、分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为2:3:2 |
| D、明矾属硫酸盐,是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,0.5 mol SO3中含有1.5NA个O原子 |
| B、常温常压下,22 g 14CO2中所含分子数为0.5NA |
| C、室温下,1 L pH=1的H2SO4溶液中含有的H+数目为0.2NA |
| D、7.8g Na2O2与足量水反应,转移电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com