
 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术.反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术.反应①为主反应,反应②和③为副反应.分析 (1)根据盖斯定律及题干中热化学方程式计算出反应2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的△H;
(2)根据反应①-③的平衡常数的对数lgK随反应温度T的变化曲线进行判断变化规律;
(3)根据图象判断900℃时反应①的lgK=2,则平衡常数为102,设出反应前CO浓度为c,根据平衡常数表达式列式计算即可;
解答 解:(1)根据盖斯定律,①×4+②+③×2可得:2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的△H=4△H1+△H2+2△H3=-151.1KJ/mol,
故答案为:-151.1KJ/mol;
(2)根据图象曲线变化可知,反应①、③为放热反应,随着温度的升高,平衡常数K逐渐减小,则lgK逐渐减小,而反应②为吸热反应,升高温度,平衡常数K逐渐增大,则lgK逐渐增大,所以Ⅰ表示的为反应③、Ⅱ曲线表示的为反应②,变化规律为:当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;根据反应①和曲线Ⅰ(反应③反应)的反应热可知,当温度同等变化时,△H的数值越大lgK的变化越大,
故答案为:当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;当温度同等变化时,△H的数值越大lgK的变化越大;(或△H的数值越大,lgK随温度的变化程度越大);
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应方程式为:$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g)△H1=-47.3kJ•mol-1,根据图象曲线可知,反应①于900℃时lgK=2,平衡常数为102=100,c平衡(CO)=8.0×10-5 mol•L-1,设一氧化碳反应前浓度为c,则反应消耗的CO浓度=反应生成二氧化碳浓度=(c-8.0×10-5)mol/L,平衡常数K=$\frac{c(C{O}_{2})}{c(CO)}$=$\frac{c-8.0×1{0}^{-5}}{8×1{0}^{-5}}$=100,解得c=8.08×10-3mol/L,一氧化碳的转化率为:$\frac{8.0×1{0}^{-3}}{8.08×1{0}^{-3}}$×100%≈99%,
答:CO的转化率为99%;
点评 本题考查了化学平衡常数的计算、热化学方程式的书写等知识,题目难度中等,试题题量较大,注意掌握化学平衡常数的概念及计算方法,明确热化学方程式的书写方法及盖斯定律的含义及应用.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:填空题
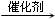
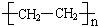 .
.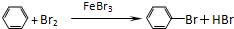 .
.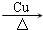 2CH3CHO+2H2O.
2CH3CHO+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
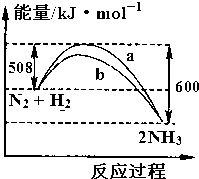
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 向一密闭容器中加入1 molN2和3 molH2充分反应后,放出92 kJ热量 | |
| C. | b曲线可能是加入催化剂时的能量变化曲线 | |
| D. | 在N2+3H2?2NH3中,反应物的键能之和大于生成物的键能之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大 | |
| B. | 将硫酸铝和氯化铝溶液分别加热蒸干后灼烧,得到的固体都是氧化铝 | |
| C. | 中和体积与物质的量浓度都相同的HCl溶液和CH3COOH溶液消耗NaOH物质的量相同 | |
| D. | 中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗NaOH物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )| A. | a 点表示的溶液中c(CH3COO-)>10-3mol/L | |
| B. | b 点表示的溶液中c(Na+)>c(CH3COO-) | |
| C. | c 点表示CH3COOH和NaOH恰好反应完全 | |
| D. | b、d 点表示的溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$均等于K |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com